二氟化二氧
無機化合物之一
二氟化二氧(dioxygen difluoride),無機化合物,化學式O2F2。結構式F-O-O-F,相對分子質量為69.996,分子結構與過氧化氫相似。但是由於氟原子的電負性大於氧原子,所以電子會向氟原子那裡偏移。所以其中的氧元素顯+1價,氟元素顯-1價。它是一種氟氧化合物,由於氟元素和氧元素都是電負性很強的元素,所以二者只能通過共用電子形成化合物,因此二氟化二氧是一種共價化合物。又因為+1價的氧元素具有極強的氧化性,故二氟化二氧是一種超強氧化劑。
在熔點以下時,二氟化二氧為黃色晶體。在熔點以上時,二氟化二氧融化成櫻紅色的油狀液體。在沸點以上時為棕色氣體。
二氟化二氧是一種性質極其不穩定的化合物,即使在-160℃的情況下也能緩慢分解為二氟化氧和氧氣。分解速率約為每天4%。按照此規律,完全分解需要25天。二氟化二氧在-57℃以下成為液體並在幾分鐘之內分解成氟氣和氧氣。升溫使其成為氣體時能爆炸式分解。溫度越高,二氟化二氧越不穩定。
二氟化二氧的氧化性極強,基本和氟原子的氧化性相當。在低於-100℃的極低溫度下也能與所有的金屬和非金屬反應(氦氖氬除外)
二氟化二氧在零下100度,可以與惰性氣體氙氣、黃金劇烈反應,將氙氧化成六價氙,將金氧化成+5價。
2Au+5O₂F₂=2AuF₅+5O₂↑
Xe+3O₂F₂=XeF₆+3O₂↑
2OF + 2PF → 2[O ]PF + F
OF + BF → [O ]BF + 1/2 F
2OF + 2AsF →2[O ]AsF +F
以上反應中,氧在反應前後從+1,降低到+1/2,氟的化合價從-1升高到0價。
二氟化二氧分子結構
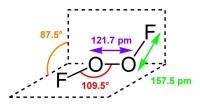
二氟化二氧結構式
將以1:1摩爾比混合的氧氣和氟氣降溫到-196℃,氣壓調節到7-17mmHg,進行輝光放電,即 可得到黃色的二氟化二氧晶體。這種化合物於1933年首次製得。
用作極強的氧化劑和氟化劑,也用於製取氧正離子鹽,還曾經被用來當作液體火箭發動機的氧化劑,但始終未能實用。