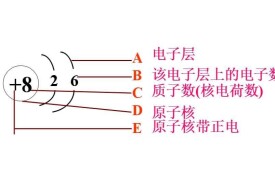
核電荷數
核電荷數
一個原子是由原子核和核外高速運動的電子所組成的。原子核又是由質子和中子(氕除外,其原子核只有質子,沒有中子)組成的(不是分兩層)每一個質子帶一個單位正電荷,中子不顯電性,有多少個質子就帶多少單位正電荷,質子所帶的正電荷數就叫核電荷序數。
核電荷數=質子數=核外電子數=原子序數(離子內則要去掉核外電子數)質子數+中子數=相對原子質量=質量數。
1913年,莫斯萊(Henry Moseley)用不同元素作為產生x射線的靶子,測定其波長。他發現,每種元素能產生特徵x射線,不同元素的特徵x射線的波長不同。他從實驗數據中總結出一個經驗公式:
1= λa (Z-b)
式中λ為特徵x射線的波長,Z為原子序數,即元素在周期系中排列次序,a、b為常數。該式表明,λ倒數的平方根與原子序數成直線關係。
莫斯萊的研究成果揭示出,元素在周期系中的“位置”具有其內在根據,它是由元素的本性決定的,通過特徵x射線波長的定量數值表現出來。這項成果確定了元素周期系的嚴格順序,從氫到鈾依次排列92種元素;同時解決了按原子量順序排列的不協調問題,即揭開了元素排列順序中原子量倒置之謎。例如,碲的序號為52,碘的序號為53,碲理應排在碘的前面。
1911年,英籍紐西蘭科學家盧瑟福(E.Rutherfovd,1871—1937)用a粒子散射實驗發現了原子核,第一個提出了關於原子結構的行星式模型。他認為原子核就像太陽居於太陽系的中心那樣居於原子的中心,若干電子就像行星環繞太陽公轉似的圍繞原子核旋轉。並且斷定原子核是集中了原子絕大部分質量的緻密小球,具有與電子截然相反的電性——正電荷,於是就把原子核具有的這種正電荷叫核電荷。不過,這種核電荷在不同元素的原子中各有多少,當時還是個未知數。
1913年,荷蘭物理學家范登布洛夫提出,原子序數等於核電荷數。
1920年,查德威克(J·chadwick)做了不同元素的α散射實驗,測定核電荷,證明核電荷數等於原子序數。由此可以解釋一系列問題。首先,解釋了位移定則和同位素現象。元素放射出α粒子,由於核電荷數減少α,相應的,原子序數減少α,元素在周期系中向左位移兩個位置;放射β粒子,核內一個中子轉變成一個質子,放射出一個電子,核電荷數增加一個單位,元素在周期系中向右移一個位置。原子核電荷相同,在周期系中即處於同一個位置,不論其原子量是多少,這就是說,同一元素核電荷數相同,原子量不同。其次,核電荷數可以確定元素原子的電子數。第三,核電荷數等於原子序數,使後者得到了物理解釋。
核電荷數等於原子序數,使元素周期系中的“位置”獲得了具體的物理意義;同時,它具體說明了“位置”是由什麼決定的問題,即由核電荷數決定的。因此,元素可以被理解為具有相同核電荷數的原子形式,或者說是具有相同核電荷數的一類原子。
1919年,盧瑟福(E·Rutherford)用α粒子轟擊氮,使氮發生核嬗變,實現了人工核反應。
• 元素概念在歷史上演變的基本線索
最初,在化學確立為科學以前,元素是構成世界萬物的本原和基礎。在近代化學形成時期,繼承了本原、基礎的 思想,演變為物質可分解的限度,把元素看作不能分解或未能分解的物質。這種元素概念隨著分解物質的技術、方法的進步,其所包含的對象的範圍(元素概念的外延),先是大於實際存在的元素範圍,繼之等於、進而小於實際存在的元素範圍,到20世紀,一切元素都是可以分解的,這種元素概念再也不能反映元素的真實情況了。在近代化學發展時期,不可分解或未能分解這個特徵被承繼下來,並被轉移到原子上,以化學原子論為基礎,使化學元素概念獲得了新的意義,化學元素表現為具有相同原子量的一類原子。在現代化學中,原子量已被證明不是元素概念的基本特徵,而元素周期系中的位置仍保留了它的意義,而且以此為基礎,進一步充實、發展,揭示了化學元素的本質特徵,元素是具有相同核電荷數的原子形式。
• 化學元素的含義通過概念的關係被揭示出來
在這個演變過程中,化學元素的含義是通過它與其他概念的關係獲得表現的,或者說是通過概念之間的關係被揭示出來的。具體地說有三種關係:第一種關係,元素和化合物的關係,元素是化合物的分解的限度,是組成化合物的成分,這個成分的具體物質形式是什麼呢?這就要求考察第二種關係,即元素和原子的關係,從這種關係來看,元素是一類原子,或原子種類,依據現代觀點,元素是具有相同核電荷數(核內質子數)的原子形式,或者說是核電荷數(核內質子數)相同的一類原子,在這個意義上,元素和原子具有相同點,每一化學元素符號既表示一種元素又表示該元素的一個原子。但是元素和原子又是有區別的,不能將二者混淆。從化學或科學的觀點說,元素是表示組成的概念,而原子可以表示組成,同時又能表示結構,表示物質的不連續性和顆粒性。因此,元素和單質既相聯繫又相區別。三種關係、三種含義是密切聯繫的,其中,化學元素是原子形式、一定種類的原子,按現代觀點,是質子數(核電荷數)相同的原子,這是化學元素概念的核心,它指出了化學元素的物質內容,而其他兩種關係,則指出了元素的存在形式,化合物是不同元素共存的形式,單質是同種元素在遊離狀態下的存在形式。
• 元素和原子是有區別的
正如上面剛剛指出過的,元素和原子是有區別的,化學元素意義上的原子量和原子意義上的原子量也是有區別的。在發現氧的同位素以後,物理學中採用O=16.00作為原子量的基準,化學中仍用天然氧原子量等於16.00作為基準。1960年,國際物理學會接受德國質譜學家馬塔斯的建議,採用C=12.00作為測定原子量的基準;1961年,國際化學會也採用這一基準。儘管如此,化學中的原子量和物理學中的原子量仍然是有區別的,或者說元素的原子量和原子的原子量是不同的。原子的原子量(或者說物理學中的原子量)在歷史上指的原子重量(atomic weight),但是,重量和質量是有區別的,重量是個可變數。國際原子能委員會認為,原子(重)量這一術語是歷史上形成的,已為使用者所理解,進而提出“原子質量”表示核素的量,以區別於元素的原子量。
• 核素和元素也是有區別的
核素和元素是有區別的。元素是指具有相同質子數的同一類原子的總稱,核素則是具有一定數目的質子和一定數目的中子的一種原子,每種元素都有一種或兩種或兩種以上的核素,現在已知元素109種,已知核素2000多種。核素和同位素也是有區別的。同位素指的是在元素周期表中佔據同一位置、質子數相同中子數不同的同一元素的原子,核素指的是質子數相同、中子數也相同的原子。
從發展的觀點看問題,過去常說的放射性“元素”,非放射性“元素”,應當用“核素”來代替。說成穩定核素、放射性核素。
•放射性元素、非放射性元素都是可以轉化的
元素,無論是放射性元素還是非放射性元素都是可以轉化的,前者可天然轉化,後者可通過人工方式實現轉化。以前那種認為元素是絕對不變的、不可轉化的觀點,最終被證明是沒有根據的。
一個原子是由原子核和核外高速運動的電子所組成的。原子核又是由質子和中子組成的(不是分兩層)每一個質子帶一個單位正電荷,有多少個質子就帶多少單位正電荷,質子所帶的正電荷數就叫核電荷數,所以核電荷數=核內質子數,我們常說氧原子的“核電荷數”是8,也就是指明氧原子的質子數是8,氧元素的原子序數為8,氧原子核外電子數是8。這是因為每一個電子是帶一個單位的負電荷,而整個原子是不顯電性的即電中性的,因此核電荷數一定等於核外電子數。