構造原理
化學定理之一
右圖中,每個小圓圈表示一個能級。每一行對應一個能層,各圓圈連線的順序表示隨核電荷數遞增而增加的電子填入能級的順序。
根據構造原理,可以將各能級按能量的差異分成能級組,如右圖所示。每一行表示一個能級組,自下而上表示n個能級組,其能量依次升高;在同一能級組內,從左到右能量依次升高。
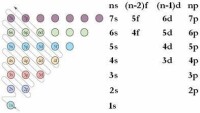
構造原理
科學家歸納大量的光譜事實得出如下結論:設想從氫原子開始,隨著原子核電荷數的遞增,原子核每增加一個質子,原子核外便增加一個電子,大多數元素的電中性基態原子的電子按順序填入核外電子運動軌道,叫做 構造原理(aufbau principle)
某些特殊原子,外部構造呈現半滿,因為半滿時原子結構更加穩定。比如:Au Ag原子等。
aufbau是德文“構造”。所謂“隨電荷遞增電子填入軌道”,是一種象形的說法,是一種思維模式,事實上單獨地考察某一個多電子原子的電子在原子核外排布是並沒有先後填入的次序。
對於同一能級,當電子排布為全充滿(d10,如29號元素Cu銅)或半充滿(d5、f7)、全空(如46號元素Pd鈀)時,能量較為穩定。
根據構造原理,絕大多數基態原子核外電子的排布都遵循下列順序:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d......
原子核外電子按能量由低到高的順序依次排布。因此,根據構造原理可以比較各能級的能量高低。
原子的核外電子不是完全按照能層順序依次排布的,即不完全是排滿n能層后再排能層,而是按照上圖所示的能級順序排布的,在該順序中,從第三能層開始,出現了能級交錯現象,該能級順序就是能量由低到高的順序。
