指紋圖譜
指紋圖譜
指紋徠圖譜是指某些複雜物質,比如中藥,某種生物體或某種組織或細胞的DNA,蛋白質經適當處理后,採用一定的分析手段,得到的能夠標示其化學特徵的色譜圖或光譜圖。指紋圖譜主要分為中藥指紋圖譜,DNA指紋圖譜和肽指紋圖譜。

甘草的HPLC指紋圖
如前所述,中藥指紋圖譜的研究以反映中藥的整體化學特徵為理論依據,提出以解決兩個關鍵技術為突破口,實現指紋圖譜技術在中藥質量控制方面的應用。它的特色主要表現在三個方面: 1、用規範化的程序獲得中藥特徵性總成分提取物,並用1HNMR、HPLC、UV、IR等多種手段表徵其組成和結構。不同的表徵手段間的區別主要表現在所得到的信息多少不同和操作上的方便程度不同。同此,核心的問題在於這種特徵性總成分提取物要有真正的特徵性,它的組成和結構要能真正代表這種中藥。
2、由於同時採用多種檢測手段來表徵中藥特徵總提物的結構和相對組成方式,因此,方便了各部門在質量控制方面可以根據自己的實際情況選擇應用。其中,由於1HNMR具有操作簡便、快速、檢測成本低、重現性好和信息量大等優點,更是中藥指紋圖譜研究的主要特色之一。
3、中藥指紋圖譜的解析研究以及中藥特徵總提物和各單體成分的生理活性研究體現了這一技術的科學性。
中藥指紋圖譜的研究將近代分離手段和儀器分析技術應用於中藥的質量控制,目的在於建立一種新的質量控制方法,因此,是一種具有創新性的研究工作。另外,每種中藥指紋圖譜的建立和對其進行的解析也均具有顯著的創新性。
中藥指紋圖譜技術已涉及眾多方法,包括薄層掃描(TLCS)、高效液相色譜法(HPLC)、氣相色譜法(GC)和高效毛細管電泳法(HPCE)等色譜法以及紫外光譜法(UV)、紅外光譜法(IR)、質譜法(MS)、核磁共振法(NMR)和X—射線衍射法等光譜法。其中色譜方法為主流方法,尤其是HPLC、TLCS和GC已成為公認的三種常規分析手段。由於HPLC具有分離效能高、選擇性高、檢測靈敏度高、分析速度快、應用範圍廣等特點。中藥成分絕大多數可在高效液相色譜儀上進行分析檢測,且積累較豐富的應用經驗。因此高效液相色譜法已成為中藥指紋圖譜技術的首選方法。隨著HPLC—MS和GC—MS等聯用技術的應用,中藥指紋圖譜技術更趨完善。
中藥指紋圖譜的建立,應以系統的化學成分研究和藥理學研究為依託,體現系統性、特徵性和穩定性三個基本原則。為此,才能保證指紋圖譜的標準化、規範化、客觀化,從而便於推廣和應用。
是指指紋圖譜中反映的化學成分應包括該中藥有效部位所含大部分成分,或指標性成分的全部,如中藥兩頭尖中抗腫瘤的有效成分為皂苷類化合物,則其指紋圖譜應儘可能地反映其中的皂苷類成分;銀杏葉的有效成分是黃酮類和銀杏內酯類,則其指紋圖譜可採用兩種方法,針對這兩類成分分別分析,達到系統全面的目的。
是指指紋圖譜中反映的化學信息(如保留時間)應具有較強的選擇性,這些信息的綜合結果,將能特徵性地區分中藥的真偽與優劣,成為中藥自身的“化學條碼”。如北五味子的HPLC指紋圖譜和TLC指紋圖譜,不僅包括多種的五味子木脂素類成分,而且具有許多未知類成分,這些成分的峰位順序、比值在一定範圍內是固定的,並且隨藥材品種不同而產生差異,依此可以很好地區別其來源、產地,判別藥材的真偽優劣。
是指所建立的指紋圖譜在規定的方法、條件下的耐用程度,即不同操作者、不同實驗室所重複做出的指紋圖譜應在所允許的誤差範圍內,以體現其通用性和實用性。因而要求包括樣品製備、分析方法、實驗過程、數據採集、處理、分析等全過程都要規範化操作,同時,還應建立相應的評價機構,對其進行客觀評價。
以指紋圖譜作為中藥(天然藥物)提取物及其製劑的質量控制方法,已成為國際共識,各種符合中藥(天然藥物)特色的指紋圖譜控制技術體系正在研究和建立。美國食品藥品管理局(FDA)允許草藥保健品申報資料中提供色譜指紋圖譜;世界衛生組織(WHO)在1996年草藥評價指導原則中也規定,如果草藥的活性成分不明確,可以提供色譜指紋圖譜以證明產品質量的一致;歐共體在草藥質量指南中亦稱,單靠測定某種有效成分考查質量的穩定性是不夠的,因為草藥及其製劑是以整體為活性物質。色譜指紋圖譜尤其是薄層色譜的鮮明的指紋圖譜是很有用的。國外指紋圖譜的應用,目的在於解決成分複雜,有效成分不明確的植物葯質量檢測和產品批次間質量差異的問題。其中德國研製的銀杏葉提取物製劑是一個突出的例子。他們應用指紋圖譜制定了相應的標準,該圖譜體現了製劑所含的33個化學成分(主要為黃酮類和內酯類)和各自的含量。經化學成分和藥效相關性研究,發現約24%銀杏黃酮和約6%銀杏內酯組成的提取物具有最佳療效。此外,採用“混批勾兌”法,可使最終產品質量穩定,指紋圖譜重現性良好,含量浮動範圍為5%左右。
20世紀70年代我國已有學者嘗試使用TLCS對中成藥進行分析,因主客觀條件的限制,技術和時機的不成熟,沒有得到公認;20世紀90年代《中國藥典》增設了中藥化學對照品和對照藥材,為中藥指紋圖譜的研究奠定了基礎。隨著色譜技術的迅速發展和檢測能力的顯著增強,為指紋圖譜的研究和應用提供了良好的技術保證。目前我國已對中藥注射劑做出了必須用指紋圖譜進行檢測的規定,同時提出了具體的技術要求;在中藥材規範化生產實施過程中指紋圖譜亦有較廣泛的應用。
但是作為一項新技術,中藥指紋圖譜在實際應用中還面臨許多問題,只有進一步加強中藥材種植加工和中成藥生產貯存的規範化;中藥化學成分和中藥藥理研究的系統化和標準化;以及技術上多學科的滲透,才能保證中藥質量的穩定,進而保證中藥指紋圖譜的建立和實施。
1. 掌握DNA指紋圖譜技術的概念、原理和基本操作過程 2. 學習DNA的限制性酶切的基本技術
3. 掌握瓊脂糖凝膠電泳的基本操作技術,學習利用瓊脂糖凝膠電泳測定DNA片段的長度,並能對實驗結果進行分析。
1984年英國萊斯特大學的遺傳學家Jefferys及其合作者首次將分離的人源小衛星DNA用作基因探針,同人體核DNA的酶切片段雜交,獲得了由多個位點上的等位基因組成的長度不等的雜交帶圖紋,這種圖紋極少有兩個人完全相同,故稱為"DNA指紋",意思是它同人的指紋一樣是每個人所特有的。 DNA指紋的圖像在X光膠片中呈一系列條紋,很像商品上的條形碼。DNA指紋圖譜,開創了檢測DNA多態性(生物的不同個體或不同種群在DNA結構上存在著差異)的多種多樣的手段,如RFLP(限制性內切酶酶切片段長度多態性)分析、串聯重複序列分析、RAPD(隨機擴增多態性DNA)分析等等。各種分析方法均以DNA的多態性為基礎,產生具有高度個體特異性的DNA指紋圖譜,由於DNA指紋圖譜具有高度的變異性和穩定的遺傳性,且仍按簡單的孟德爾方式遺傳,成為目前最具吸引力的遺傳標記。
DNA指紋具有下述特點:
1.高度的特異性:研究表明,兩個隨機個體具有相同DNA圖形的概率僅3×10-11;如果同時用兩種探針進行比較,兩個個體完全相同的概率小於5×10-19。全世界人口約50億,即5×109。因此,除非是同卵雙生子女,否則幾乎不可能有兩個人的DNA指紋的圖形完全相同。2.穩定的遺傳性:DNA是人的遺傳物質,其特徵是由父母遺傳的。分析發現,DNA指紋圖譜中幾乎每一條帶紋都能在其雙親之一的圖譜中找到,這種帶紋符合經典的孟德爾遺傳規律,即雙方的特徵平均傳遞50%給子代。3.體細胞穩定性:即同一個人的不同組織如血液、肌肉、毛髮、精液等產生的DNA指紋圖形完全一致。
1985年Jefferys博士首先將DNA指紋技術應用於法醫鑒定。1989年該技術獲美國國會批准作為正式法庭物證手段。我國警方利用DNA 指紋技術已偵破了數千例疑難案件。DNA指紋技術具有許多傳統法醫檢查方法不具備的優點,如它可以從四年前的精斑、血跡樣品中,仍能提取出DNA來作分析;如果用線粒體DNA檢查,時間還將延長。此外千年古屍的鑒定,在俄國革命時期被處決沙皇尼古拉的遺骸,以及在前南地區的一次意外事故中機毀人亡的已故美國商務部長布朗及其隨行人員的遺骸鑒定,都採用了DNA指紋技術。
此外,它在人類醫學中被用於個體鑒別、確定親緣關係、醫學診斷及尋找與疾病連鎖的遺傳標記;在動物進化學中可用於探明動物種群的起源及進化過程;在物種分類中,可用於區分不同物種,也有區分同一物種不同品系的潛力。在作物的基因定位及育種上也有非常廣泛的應用。
DNA指紋圖譜法的基本操作:

DNA指紋圖譜試驗
在基因工程的常規操作中,瓊脂糖凝膠電泳應用最為廣泛。它通常採用水平電泳裝置,在強度和方向恆定的電場下進行電泳。DNA分子在凝膠緩衝液(一般為鹼性)中帶負電荷,在電場中由負極向正極遷移。DNA分子遷移的速率受分子大小,構象。電場強度和方向,鹼基組成,溫度和嵌入染料等因素的影響。
1. DNA樣品:犯罪現場DNA樣品(CS)、嫌疑犯1 DNA樣品(S1)、嫌疑犯2 DNA樣品(S2)、嫌疑犯3 DNA樣品(S3)、嫌疑犯4 DNA樣品(S4)、嫌疑犯5 DNA樣品(S5)。
2.化學試劑和溶液
(1)DNA樣品反應緩衝液:100mM Tris,200mM NaCl,20mM MgCl2,2mM DTT,pH 8.0
(2)EcoRⅠ限制性內切酶
(3)PstⅠ限制性內切酶
(4)電泳緩衝液(50×TAE)
Tris 242g
冰醋酸 57.1ml
EDTA(0.5mol/L pH 8.0) 100ml
使用時用蒸餾水稀釋50倍。
(5)樣品緩衝液(DNA sample loading dye)
0.25%溴酚藍
0.25%二甲苯青
40%(W/V)蔗糖
(6)溴化乙錠(EB) 10mg/ml
(7)瓊脂糖agarose(電泳級)
(8)DNA分子量標記物:Lambda HindⅢ DNA markers
3. 儀器設備和消耗品
電泳儀、電泳槽、樣品梳、微波爐、水浴鍋、移液器(10μl,200μl,1000μl)、離心管、一次性槍頭(200μl,1000μl)。
1. DNA樣品的製備
採集生物檢測樣本,在弱鹼和螯合劑存在條件下進行組織勻漿,溶解細胞或細胞核膜;利用陰離子去垢劑和蛋白酶,在37孵化數小時,消化蛋白質分離 DNA;使用有機溶劑如苯酚、氯仿等除去殘餘蛋白質,萃取DNA;用乙醇或某些鹽類從溶液中沉澱DNA。
由於一般採集的樣本中的DNA都有不同程度的降解,採用PCR技術擴增出完整的基因組DNA或者特定的高可變位點,以此製備出的DNA樣品備用。
2. DNA樣品的酶切反應
設置DNA樣品的雙酶切反應,按圖順序加樣品(體積:μl):
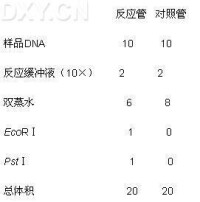
加樣品順序
3. 酶切產物的瓊脂糖電泳
(1)在100ml電泳緩衝液(1TAE或0.5TBE)中加入1g瓊脂糖,加熱熔化,注意觀察,當心煮沸的液體溢出!當凝膠冷卻至60℃左右時加入5ul溴化乙錠溶液(終濃度為1ug/ml),充分混勻。
(2)先用透明膠帶封固膠托邊緣,放好梳子,然後再倒入凝膠(凝膠厚度在5mm左右)。
(3)在凝膠完全凝固后(室溫放置30~45分鐘),小心移去梳子和透明膠帶,將凝膠放入電泳槽中,加入電泳緩衝液(液面超過膠帶約2~3mm)。
(4)取已製備好的酶切DNA樣品,加入1/5樣品緩衝液,充分混勻。用移液器將樣品小心地加入點樣孔。在不同的點樣孔中,分別加入DNA分子量標記物,對照以及酶切DNA樣品各5~10ml。
(5)蓋上電泳槽,打開電源並調節電壓(通常用50~100伏),電泳40~60分鐘(注意:DNA樣品從負極向正極泳動)。
4. 結果觀察與分析
關閉電源,取出凝膠,在紫外燈下觀察DNA的遷移位置,並討論實驗結果。判斷CS與哪一個DNA樣品是同一個樣品,找出罪犯。
(1)酶徠切時,應盡量減少反應中的加水量以使反應體系減到最小。但要確保酶體積不超過反應總體積的十分之一,否則限制酶活性將受到甘油的抑制。
(2)進行酶切消化時,將除酶以外的所有反應成分加入后再從冰箱中取出酶,並應放置於冰上。每次取酶時都應換一個無菌吸頭。操作要儘可能快,用完后立即將酶放回冰箱。
(3)溴化乙錠是一種強烈的致癌物質,使用時必須帶手套。實驗結束后,含溴化乙錠的凝膠要進行凈化處理。
