氧化鋰
氧化鋰
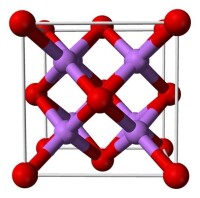
氧化鋰(Lithium oxide),分子式為Li2O,分子量為29.88。是鋰最常見的氧化物,它被廣泛用作玻璃的組分。

氧化鋰
該品在下列溫度時的溶解度為:6.67g/100g水(0℃),10.02g/100g水(100℃)。
一般來說,氧化鋰是藉由鋰在氧氣中燃燒而產生。由於鋰離子半徑較小,極化能力比較強,因此燃燒反應主要產物是氧化鋰,只產生少量的過氧化鋰。
4Li + O→ 2LiO
在空氣中容易吸收水分和CO從而變質稱為LiOH和LiCO。與水接觸會生成強鹼性的氫氧化鋰。
LiO + HO → 2LiOH
氧化鋰與酸反應生成鋰鹽。高溫下,氧化鋰可以和許多金屬氧化物和固態非金屬氧化物反應,這是氫氧化鋰、碳酸鋰和氧化鋰助熔性質的基礎。
xLiO + ySiO→ xLiO·ySiO
而硅、鋁能把鋰從它的氧化物中還原出來。
2LiO + Si → 4Li + SiO(高溫)
氣態時,氧化鋰以直線型的LiO分子存在,Li-O鍵長與強離子鍵鍵長相近。(這與價層電子對互斥理論所預測的角形分子不符。)
1、可由金屬鋰直接在氧氣中燃燒生成氧化鋰:
Li + O→ LiO
2、也可以在氦氣流中加熱過氧化鋰至450℃得到:
2LiO→ 2LiO + O
3、在氫氣氛中將碳酸鋰、硝酸鋰或氫氧化鋰加熱到800℃都可以製得氧化鋰:
LiCO→ LiO + CO
4LiNO→ 2LiO + 4NO+ O
2LiOH → LiO + HO
將純凈的碳酸鋰放在瓷管內的鉑盤中,減壓,同時加熱至700℃以上使其分解,保溫50h,直至檢查不再有氣體產生為止;然後繼續在乾燥的氫氣流中加高熱,使殘餘碳酸鋰完全分解。此時鉑盤中的白色殘留物質即為氧化鋰。
常溫密閉,陰涼通風乾燥。
眼睛:用流動清水沖洗(15 分鐘),就醫。
皮膚:脫去被污染的衣服,用水和肥皂沖洗。
吸入:清理鼻腔,用水漱口。
1、用作光譜純試劑;
2、電池級氧化鋰主要電池材料的製備;
3、還被用於特種玻璃、陶瓷、醫藥等領域。
危險運輸編碼:UN 3262 8/PG 2
危險品標誌:腐蝕
安全標識:S26S45S36/S37/S39
危險標識:R34
1、疏水參數計算參考值(XlogP):無
2、氫鍵供體數量:1
3、氫鍵受體數量:1
4、可旋轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:1
7、重原子數量:3
8、表面電荷:1
9、複雜度:2.8
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:3