氘
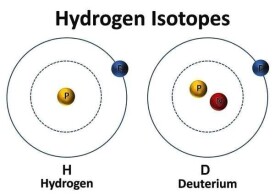
氫的同位素
氘(dāo),氫(H)的同位素,也被稱為重氫,元素符號一般為D或2H。氘原子核中有一個質子和一個中子,其相對原子量為普通氫的二倍。氫中有0.02%的氘,在大自然的含量約為一般氫的七千分之一。氘用於熱核反應,聚變時放出β射線后形成質量數為 3 的氦,並在化學和生物學的研究工作中作示蹤原子。氘被稱為“未來天然燃料”。
氘(deuterium)為氫的一種穩定形態同位素,也被稱為重氫,元素符號一般為D或2H。它的原子核由一顆質子和一顆中子組成。在大自然的含量約為一般氫的7000分之一。
氘
(1)由重水電解。
(2)由液氫低溫精鎦。
【三相點】-254.4℃;
【液體密度】(平衡狀態,-252.8℃):169g/cm³;
【氣體密度】(101.325kPa,0℃):0.180g/cm³;
【比熱容】(101.325kPa,21.2℃】:5.987m3/kg
【氣液容積比】(15℃,100kPa):974L/L;
【壓縮係數】:
壓強(kPa)
100
1000
5000
10000;
溫度(℃)
15
50
1.0087
1.0008
1.0060
1.0057
1.0296
1.0296
1.0600
1.0555;
【臨界溫度】:-234.8℃;
【臨界壓強】1664.8kPa;
【臨界密度】66.8g/cm3;
【溶化熱】(-254.5℃)(平衡態):48.84kJ/kg;
【氣化熱】ΔHv(-249.5℃):305kJ/kg;
【比熱容】(101.335kPa,25℃,氣體):Cp=7.243kJ/(kg·℃),Cv=5.178kJ/(kg·℃);
【比熱比】(101.325kPa,25℃,氣體):Cp/Cv=1.40;
【蒸氣壓強】
(正常態,17.703):10.67kPa;
(正常態,21.621):53.33kPa;
(正常態,24.249K): 119.99kPa;
【粘度】
(氣體,正常態,101.325kPa,0℃):0.010lmPa·S;
(液體,平衡態,-252.8℃):0.040mPa·s;
【表面張力】(平衡態,-252.8℃):3.72mN/m;
【導熱係數】
(氣體101.325kPa,0℃):0.1289w/(m·K);
(液體,-252.8℃):1264W/(m·K);
【折射係數】nv(101.325kPa,25℃):1.0001265;
【空氣中的燃燒界限】5%~75%(體積);
【易燃性級別】4;
【毒性級別】0;
【易爆性級別】1;重氫在常溫常壓下為無色無嗅無毒可燃性氣體,是普通氫的一種穩定同位素。它在通常水的氫中含0.0139%~0.0157%。其化學性質與普通氫完全相同,但因質量大,反應速度小一些。
氘無毒,有窒息性。重氫有易燃易爆性,所以對此須引起足夠的重視。瓶裝氣體產品為高壓充裝氣體,使用時應經減壓降壓後方可使用。包裝的氣瓶上均有使用的年限,凡到期的氣瓶必須送往有部門進行安全檢驗,方能繼續使用。每瓶氣體在使用到尾氣時,應保留瓶內余壓在0.5MPa,最小不得低於0.25MPa余壓,應將瓶閥關閉,以保證氣體質量和使用安全。瓶裝氣體產品在運輸儲存、使用時都應分類堆放,嚴禁可燃氣體與助燃氣體堆放在一起,不準靠近明火和熱源,應做到勿近火、勿沾油臘、勿爆曬、勿重拋、勿撞擊,嚴禁在氣瓶身上進行引弧或電弧,嚴禁野蠻裝卸。
就在查德威克宣布發現中子的論文送交《自然》雜誌的第二天,美國的《物理學報》收到了美國哥倫比亞大學教授尤里(H.C.Urey,1893-1981)等的一篇重要文章,報告說已經發現了質量為2的氫的同位素氘。
1931年底,美國科學家哈羅德·克萊頓·尤里(Harold Clayton Urey)在蒸發了大量液體氫之後,利用光譜檢測的方法發現了重氫(氘,D)。尤里因此在1934年獲得諾貝爾化學獎。
根據尤里的建議,重氫被命名為“Deuterium”,在希臘語中是“第二”的意思。
氘氣的分離原理可分為兩類:一種是直接利用質量同位素效應,不同質量的單個同位素分子、離子在重力場、電場中的運動差異;另一種是利用同位素的統計特性差異,氘的主要製備方法有液氫精餾法、電解重水法、鈀/合金薄膜或金屬氫化物法等。
氘主要的化合物為重水(D2O),氣態氘可用鈉或赤熱的鐵分解重水,或在碳酸鈉存在時電解重水獲得,重水電解是製取氘的主要方法。重水電解制氘原理與電解水制氫原理完全相同,在陰極上產生氘氣,在陽極上產生氧氣,但其使用固體電解質-磺酸基團結合在聚四氟乙烯上,導電介質是水合氘離子(D・D2O),而磺酸基是不移動的。
採用普通電解水裝置,以氘氧化物為電解質(如:KOD、NaOD),或者採用SPE( SolidPolymer Elec-trolyte)膜電解槽電解重水,在陰極上可得到丰度為99%的氘氣,再經過分離、凈化可得到高純氘產品。此法技術含量高,規模可大可小,易於控制,安全可靠。
由於氘化物的分解壓高於氫化物的分解壓,同一金屬對氫、氘吸收平衡壓與分解平衡壓不同,利用這種壓差特性以及它們的活化能差別就可以進行氫、氘的分離,其適合於對含氘氣體進行分離凈化使用及核電站托卡馬克廢氣的回收利用。
氘在天然氫中的含量為0.0139%~0.0156%,D2的沸點為23.5K,H2為20.38K,HD(氘化氫)的沸點為22.13K。由精餾液氫來製取氘氣,理論上是完全可能的。在低溫精餾時首先濃縮的是HD,HD必須經催化劑轉化為D2,HD、H2的平衡混合后才能繼續精餾濃縮。低溫精餾分離氫同位素的流程主要有4種,即四塔流程、三塔流程、二塔流程及帶有側線返回進料平衡裝置的二塔流程。
電解重水製備的氘氣中主要雜質有 N2、O2、HD和少量H2等。
雜質氮氣的脫除,雜質氮氣主要來源是空氣在重水中有一定的溶解度以及系統的污染滲透,降低氮氣含量需要做好系統的密封性,同時也可利用活性炭、硅膠或分子篩等吸附劑在低溫情況下吸附使氮氣降低。
雜質氧氣的脫除,雜質氧氣主要來源於電解水分解的氧,同時也有管路系統的滲透而引入的氧,利用脫氧催化劑進行雜質氧的脫除。
雜質HD的脫除,電解重水製取的氘氣中含量最大的雜質是HD,HD的去除可採用熱循環吸附工藝(TCAP),該方法使用的工作介質是Pd-Al2O3,HD含量也可利用活性氧化鋁、分子篩等在催化劑作用下通過低溫吸附分離來降低。
雜質H2的脫除,氘中雜質H2的去除可採用鈀膜或金屬氫化物法,特別是對於重水電解所得氘氣的凈化非常合適。氫和氘在金屬中都以原子狀態存在,氫在金屬中的吸附力大於氘,氫雜質優先牢固吸附在金屬中形成氫化物,由此氘中氫就被除去,高純氘流出。經過一定的時間再將氫化物進行加溫、真空脫附等措施,從而獲得高純氘。
從“進口”上說,可控核聚變所需的反應原料(氘原子和氚原子),在地球上非常豐富。氘在海水中儲量極大,熱核聚變實驗堆一旦研究成功,就能利用海水發電,一升海水中提取的氘經過聚變反應釋放的能量相當於300升石油。而氚可通過中子與鋰反應生成,在地殼和海水中,鋰都是大量存在的。
氫燈和氘燈是紫外區的常用光源,它們在180~375nm波長範圍內產生連續輻射,在相同操作條件下,氘燈的發射強度比氫燈約大4倍。玻璃對這段波長範圍內的輻射有強烈吸收,必須採用石英光窗。紫外可見分光光度計同時配有紫外和可見兩種光源。
氘氣屬是有窒息性和易燃易爆性的氣體,一般採用帶有CGA350 閥門的40L專用鋼瓶包裝。包裝的氣瓶上均有使用的年限,凡到期的氣瓶必須送往有部門進行安全檢驗,方能繼續使用。氘氣瓶裝氣體產品為高壓充裝氣體,使用時應經減壓降壓後方可使用。每瓶氣體在使用到尾氣時,應保留瓶內余壓在0.5 MPa,最小不得低於0.25 MPa余壓,並將瓶閥關閉,以保證氣體質量和使用安全。
氘氣瓶裝氣體產品在運輸儲存、使用時都應分類堆放,應貯存於陰涼、通風場所,溫度不宜超過30 ℃,場所需配置相應品種和數量的消防器材。嚴禁可燃氣體與助燃氣體堆放在一起,不準靠近明火和熱源,應做到勿近火、勿沾油蠟、勿暴晒、勿重拋、勿撞擊,嚴禁在氣瓶身上進行引弧或電弧,嚴禁野蠻裝卸。搬運時輕裝輕卸,防止氣瓶及附件破損。

氘
同位素這個名詞的西文isotope是英國人索迪(F.Soddy,1877-1956)於1911年開始使用的。後來,另一位英國人阿斯頓(F.W.Aston,1877-1945)在1919年製成了質譜儀,可以用來分離不同質量的粒子,並且測定它們的質量。這就把研究同位素的方法提高了一大步。阿斯頓先後利用質譜儀發現了很多元素的同位素,他在71種元素之中,陸續找到了202種同位素之多,這為我們認識同位素,開始積累了大量資料。
最引人關注的是,氫有沒有同位素的問題。為了尋找氫的同位素,人們前後用了十幾年的時間,而沒有得出肯定的結果。1931年初,有人從理論上推導,認為應該有質量數為2的氫同位素存在,並且估算出2H:1H=1:4500的比例。1931年年底,美國哥倫比亞大學的尤里教授和他的助手們,把四升液態氫在三相點14°K下緩慢蒸發,最後只剩下幾立方毫米液氫,然後用光譜分析。結果在氫原子光譜的譜線中,得到一些新譜線,它們的位置正好與預期的質量為2的氫譜線一致,從而發現了重氫。尤里對它定了一個專門名,稱“deuterium”(中文譯為“氘”,符號“D”)。後來英、美的科學家們又發現了質量為3的“tritium”(中文譯為“氚”,符號“T”),是具有放射性的另一重要氫同位素。
氘的發現是科學界在二十世紀三十年代初的一件大事。尤里因此在1934年榮獲了諾貝爾化學獎金。他的聲譽從此飛躍,可是他並未停止不前,後來還繼續完成了很多重要研究工作。現在最常見的是氧化氘(又名重水),它的主要特性:氧化氘最大密度的溫度是11.22℃(普通水是4.08℃),熔點是3.82℃,沸點是101.42℃,這些特性與普通水都大不相同。重水易於用電解水而取得,所以電費低廉的北歐能大量生產。後來重水成為製造氫彈的重要材料之一。
以上簡單地敘述了一下氘和重水,是想由此引起人們對這位化學家尤里的重視。他是去年一月六日才以八十六歲的高齡病故的。下面(此文發表於1982年—編者注)扼要地介紹他的生平和業績,表示我們對他的敬念。哈羅德·克萊頓·尤里(HaroldClaytonUrey)於1893年4月29日生在美國西北部印第安納州的一個農民家庭里。中學畢業之後,他先在一個農村的小學里教了三年書。後來才進了蒙大拿州立大學,他當時的主修課是生物學,以化學作為副系。可是他一生的主要成就,卻由副系化學提供了基礎。他畢業后得到了獎學金,從1921年到1923年在美國加州大學進修。成績優異,三十歲時,取得了博士學位。1923年他又得了出國進修的獎學金,去丹麥跟波爾教授專門研究原子結構理論。尤里回國以後,先在約翰·霍普金斯大學擔任講師。1929年到哥倫比亞大學擔任化學系副教授,他在這裡和別人合作,寫了一本專著,書名是《原子、分子和量子》(Atoms、MoleculesandQuanta)。這是用英文寫的關於量子力學的名著之一。這說明了尤里對於量子力學和熱力學,以及核結構的成就,本來早已經達到相當高的水平了。在這期間,他用光譜法發現了驚人的氫同位素之一,氘。尤里從此以後,成為同位素化學方面公認的權威。經過他的研究,使同位素的分離開始有了化學方法。由於這種方法的成功,很多同位素才成為化學的、生物學的、地質學等方面的示蹤物。在二次世界大戰時,他利用同位素化學的豐富知識對最後戰勝日本起了重大的作用。過去同位素的分離,只是在極小的範圍內,用實驗室的規模進行的。二次大戰期間,尤里領導了一批助手,使重水分離和鈾同位素的大規模分離,這一技術方面的成功,便使第一批原子彈的生產成為可能。戰後,尤里接受了芝加哥大學的聘請,擔任教授。在這裡,他發表了一篇極重要的論文,這篇論文的題目是《同位素物質的熱力學性質》。此後,尤里利用了高度精確的質譜儀,來檢驗地質和海洋中的氧同位素的百分比。由於這項技術的成功,他能相當準確地計算出七千萬年前海洋的溫度。
他在1952年發表了宇宙間元素丰度的數據,發展了元素起源和宇宙學理論。地的專著《行星:其起源和發展》(ThePlanets:TheirOriginandDevelopment)一書中,從化學過程來討論太陽系演化的學說,指出行星是由圍繞在原始太陽周圍的塵埃聚集成的。地球的原始大氣應當和現在的木星大氣相似,主要由甲烷、氨和氫所組成。地球現在的大氣是經幾個長期階段的變化形成的。1953年尤里和學生米勒(StanleyL.Miller)設計了一套儀器,模擬原始地球大氣的成份和條件,在甲烷、氨、氫和水蒸氣混合物中,連續進行了一星期的火花放電后,形成了十多種氨基酸。這說明了原始大氣產生蛋白質的可能。這為研究生命起源問題開展了重要途徑。1968年他六十五歲時,被加州大學聘為海洋研究所的高級研究員,他又提出了太陽系由隕石形成的理論,並認為在別的行星上也可能產生生命。尤里還是研究月球表面的專家。阿波羅登月取回月岩的樣品,就是由尤里主持參加研究的。在海盜號火箭探索火星計劃中,尤里又擔任重要顧問。尤里在四十一歲時榮獲諾貝爾化學獎外,他還先後得到各國政府、學術團體和科學組織授予的三十多種獎章和獎品,美國一些大學授給他十六個榮譽博士學位,其他國家的大學也曾授予他九個榮譽學位。這說明了世界上學術界對他的科學成就之重視。在尤里一生的最後十年中,他把很多精力放在反對原子武器的破壞作用上。他早就認為美國不可能獨佔核武器,他主張美國和蘇聯都應當減少原子武器,使世界長期和平可能達到。他在臨終之前,還一再強調,原子能只能用於和平目的。他多年來所做的大量公開講演講和文字呼籲,曾經得到美國好些知識分子的同情,儘管有人不同意尤里的一些觀點,但沒有人懷疑,他的主張是真誠的和發自內心的。哈羅德。尤里的業績將永垂於化學史上。
如果把氘(或者說重水)說成是有毒物質是完全錯誤的。這就好像空氣一樣,空氣中約4/5是氮氣,這對生物是沒有任何危害的。如果空氣中氮氣比例過高,人就會窒息而亡,但這並不說明氮氣是有毒氣體。同樣道理,普通水中含有微量的重水,這對生命並沒有影響,當重水含量很高時,人體會受到傷害,而這也並不說明氘是有毒物質。