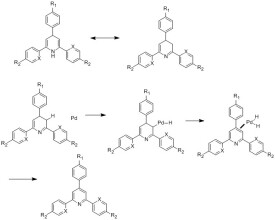
脫氫
脫氫
脫氫(Dehydrogenation)是一種化工單元過程,是氫化的相反過程,是減少有機物分子中的氫原子數目的過程,一般有兩種方法:。脫氫一般在較高的溫度(300~800°C)下才具有一定的反應速度,但相應地裂解副反應速度也會加快。
Dehydrogenation
催化脫氫 - 主要使用 催化劑使有機物中碳-氫鏈斷裂,達到脫氫的目的,同時還要維持更容易斷裂的碳-碳鏈,不使其斷裂,因此必須選擇合適的催化劑。
氧化脫氫 - 氧非常容易和氫原子結合成 水分子,因此在脫氫過程中通入氧能使氫原子更容易脫離其結合的有機物分子,這種方法主要用於有機物及其脫氫產物不和水反應的情況下。
從
脫氫

脫氫
有機化合物的分子中脫出氫原子的反應過程。脫氫時化合物分子中的碳-氫、氧-氫或氮-氫鍵斷裂,氫被解離生成氫分子(H2)。若氫原子同時被氧化而生成水,則稱氧化脫氫。脫氫的結果是
早在1889年就實現了由 甲醇脫氫制 甲醛的工業生產。20世紀20年代起,先後實現了 異丙醇脫氫制 丙酮、乙苯脫氫制 苯乙烯、丁烷脫氫制 丁烯、丁烯脫氫制 丁二烯、正丁烯氧化脫氫制丁二烯等的工業生產。
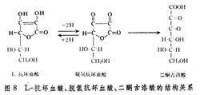
脫氫
。催化脫氫可分為:①碳-氫鍵催化脫氫,如烷烴、烯烴、芳烴和環烷烴等的脫氫:
CH3CH2CH2CH3─→CH2=CH-CH=CH2+2H2
CH3CH2CH=CH2─→CH2=CH-CH=CH2+H2
②氧-氫和氮-氫等鍵的催化脫氫,如醇(直鏈醇、環烷醇)和胺的脫氫:
③有氧化反應參加的脫氫反應(氧化脫氫),例如丁烯轉化成丁二烯:
CH2=CHCH2CH3+½O2─→CH2=CH-CH=CH2+H2O
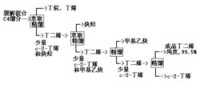
脫氫
氫催化劑使用。但是,由於脫氫和加氫反應條件不同,在選擇催化劑時,除注意催化活性外,還應注意以下幾點:①耐熱性好,保證在脫氫高溫環境中不被燒結;②化學穩定性好,在較高溫度下具有抗氫氣還原和抗水蒸氣侵蝕的能力;③脫氫比加氫易使催化劑表面結焦,應易於進行催化劑再生。常用的催化劑為各種金屬氧化物(如氧化鐵、氧化鉻、氧化鋅、氧化鎂)和各種金屬(如銅、銀、鎳、鉑)等。氧化脫氫催化劑除具有脫氫催化劑的性能外,還應具有催化氧化性能,常用的是混合氧化物催化劑(如鉬、鉍的氧化物,鐵、銻的氧化物等),也可用金屬催化劑。
脫氫是可逆、吸熱、分子數增加的反應,高溫和低壓有利於反應的進行。為此,必須採用選擇性良好的催化劑,並用減壓操作以盡量降低反應溫度。但低壓操作有漏入空氣引起爆炸的危險,工業上一般是向反應系統通入水蒸氣,以降低反應物的分壓,並能提供反應所需的熱量,消除及減輕催化劑的結焦。採取氧化脫氫,可使生成的氫被氧化成水而除去,促使反應移向脫氫方向,以提高轉化率;同時氧化放出大量的熱,可供給脫氫吸熱的需要。以甲醇為例:甲醇脫氫反應
反應由脫氫吸熱轉變為氧化脫氫放熱,不僅反應轉化率高,而且反應溫度可降低,催化劑積炭減少,壽命延長。氧化脫氫的缺點是易引起氧化副反應。
催化脫氫反應器有 固定床反應器,如列管式、圓柱型絕熱床單段或多段反應器和徑向反應器,以及 流化床反應器。反應器的材質要有耐高溫和抗氫蝕的能力。
脫氫主要用於將 丁烷脫氫形成 丁二烯作為合成 腈綸或合成 橡膠的原料;將 異戊烯脫氫形成 異戊二烯作為 合成橡膠原料;將 乙苯脫氫成為 苯乙烯做 合成樹脂、合成纖維的原料等;將 甲醇直接 氧化成 甲醛也是一種脫氫過程。