二醇
二醇
分子中含有兩個羥基的醇。兩個羥基須分別位於相鄰或相隔一個或者多個碳的碳原子上,如果兩個羥基位於同一個碳原子上,則迅速失水,形成羰基徠。在自然界存在極少,只在糖及其類似物的各種發酵物中得到少量低級脂肪二醇。如乙二醇,1,3-丙二醇、2,3-丁二醇等,但未發現環二醇和芳香二醇。
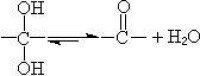
二醇
鏈狀脂肪二醇從含6個碳原子開始皆為固體,不足6個碳原子的二醇為粘稠液體。環二醇,如環戊或環己二醇也都是固體。苯基取代的脂肪二醇中,其中一個羥基位於α碳上則容易形成固體;兩個羥基都距芳基較遠時,則往往難成為固體。最簡單的二醇,如乙二醇、丙二醇可在常壓下蒸餾,其他的低級二醇須減壓蒸餾,否則容易失水。通常每增加一個碳原子,沸點約升高10~15℃,但二醇沸點相差25~30℃。一般兩個羥基相距越遠,沸點越高(氫鍵的影響)。例如 二醇的沸點比其相應的同分異構體高15~20℃。但羥基位於三級碳上的二醇比相應的其他二醇的沸點低。
方法很多,主要包括:二鹵代烴、鹵代醇、環氧化合物的直接或間接水解;二元醛、酮、酸及羰基酸的氫化;羥基醛、酮、酸、環氧化合物的還原;二烯的水合;烯烴的氧化等。這些方法製得的二醇產物與原料的碳原子數相同。用格利雅試劑與二元醛、酮或酯反應,則可得到比原料碳原子數多的二醇,並能製得環二醇。用羥醛縮合(見縮合反應),也可得到碳原子數增多的產物。
高碘徠酸
高碘酸(HIO)、偏高碘酸鉀(KIO)、偏高碘酸鈉(NaIO)的水溶液可以使1,2-二醇的碳碳鍵斷裂,羥基氧化成相應的醛、酮,並且能夠定量的反應。因此根據高碘酸的消耗量可以推知多元醇中所含相鄰醇羥基的數目。反應過程中生成了環狀酯中間體。多元醇如果其羥基均處於相鄰的位置,在與一分子高碘酸反應后得到α-羥基醛或酮,可進一步與高碘酸反應,其過程和1,2-二醇類似,形成環狀酯中間體。對於多羥基化合物的氧化產物,可簡單看做是醇羥基所連接的碳原子之間的碳斷裂,斷裂部分各與一個羥基結合,然後失水,這樣可以方便的推出最終的氧化產物。另一方面,也可以根據HIO消耗數量及氧化產物來推測原化合物的結構。
四醋酸鉛
1,2-二醇可以被四醋酸鉛[Pb(OAc)]氧化,通常在醋酸或苯溶液中進行,反應是定量的,因此也用於1,2-二醇的定量分析。但此試劑能與其他含羥基的分子反應,因此不能用水或醇作溶劑,但少量水,特別是醋酸,對氧化反應並無大礙。
1,2-二醇可以被四醋酸鉛氧化的過程與被高碘酸氧化的過程一樣,其氧化過程也是經過了環狀酯中間體。順型的1,2-二醇比反型的相對速率大得多,這與形成環狀酯中間體有關,反型的環狀酯因五元環的扭曲而不易形成,但如果用吡啶作反應溶劑,會加快反-1,2-二醇的反應速率。
這類反應最初是從頻那酮發現的,因此這類重排稱為頻那酮重排,α-雙二級醇、α-二級醇三級醇、α-雙三級醇均能發生這類重排。這類重排發生的機理,首先在酸的作用下發生羥基質子化形成(i),(i)失水形成碳正離子(ii),相繼發生基團的遷移,缺電子重心轉移到羥基的氧原子上(iii),(ii)中帶正電荷的碳為6電子,(iii)中氧鹽中的氧為8電子,所以(iii)比(ii)穩定,這是促使重排發生的原因,(iii)失去質子生成頻那酮。不對稱的乙二醇中,一般能形成比較穩定的碳正離子的碳上的羥基易被質子化。
醇,是指羥基與一個脂肪族烴基相連而成的化合物;羥基與苯環相連,則由於化學性質與普通的醇有所不同而分類為酚;羥基與sp2.雜化的雙鍵碳原子相連,屬烯醇類,該類化合物由於會互變異構為酮,因此大多無法穩定存在。
一、醇的分類、結構和物理性質
1、醇的分類
根據羥基所連接的碳原子的級分類,羥基連在一級碳原子上的醇稱為一級醇,也稱為伯醇;羥基連在二級碳原子上的醇稱為二級醇,也稱為仲醇;羥基連在三級碳原子上的醇稱為三級醇,也稱為叔醇。羥基與不飽和碳原子相連的醇很不穩定,稱為烯醇,它很快會異構化為醛、酮。
2、醇的熔點和沸點
低級醇的熔點和沸點比碳原子數相同的碳氫化合物的熔點和沸點高得多,這是因為醇分子間有氫鍵締合作用。醇在固態時,締合較為牢固,液態時,氫鍵斷開后,還會再形成,但在氣相或非極性溶劑的稀溶液中,醇分子彼此相距甚遠,各個醇分子可以單獨存在。分子間氫鍵隨著濃度的升高而增加,分子內氫鍵卻不受濃度的影響。
3、醇的結構
一般情況下,相鄰的兩個碳原子上最大的兩個基團處於對交叉構象最穩定,是優勢構象,擔當這兩個基團可能以氫鍵締合時,由於形成氫鍵可以增加分子的穩定性。兩個分子處於臨交叉構象成為優勢構象。
二、醇的酸鹼性
酸醇的酸性和鹼性與和氧相連的烴基的電子效應相關,烴基的吸電子能力越強,醇的鹼性越弱,酸性越強。相反,烴基的給電子能力越強,醇的鹼性越強,酸性越弱。烴基的空間位阻對醇的酸鹼性也有影響,因此分析烴基的電子效應和空間位阻影響是十分重要的。
