金剛石結構
金剛石立方晶體結構
在晶體學中,金剛石結構又稱為金剛石立方晶體結構(diamond cubic lattice structure),原型是金剛石。金剛石結構中的每個原子與相鄰的4個原子形成正四面體。具有金剛石結構的晶體除了金剛石以外,還有硅、鍺、α-錫等。
金剛石結構的原型是金剛石晶體,又稱鑽石。在金剛石晶體中,每個碳原子都以雜化軌道與另外4個碳原子形成共價鍵,構成正四面體。由於金剛石中的C-C鍵很強,所以金剛石硬度大,熔點極高;又因為所有的價電子都被限制在共價鍵區域,沒有自由電子,所以金剛石不導電。
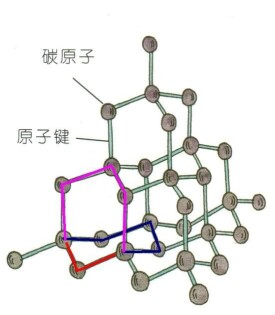
金剛石結構是一種由兩個面心立方點陣沿立方晶胞的體對角線偏移單位嵌套而成的晶體結構,屬於面心立方布喇菲點陣(Bravais lattice), 立方晶系,Fd-3m (227號)空間群。如果立方晶胞的晶格常數是a, 則金剛石結構的原胞的基矢是每個原胞含有兩個原子,在原胞中的坐標分別是 和 . 金剛石結構的每個結晶學原胞(即晶胞)含有8個原子,在晶胞中的坐標分別是
金剛石結構的原型是金剛石的晶體結構。在金剛石晶體中,每個碳原子的4個價電子以雜化的方式,形成4個完全等同的原子軌道,與最相鄰的4個碳原子形成共價鍵。這4個共價鍵之間的角度都相等,約為109.28度,精確值,這樣形成由5個碳原子構成的正四面體結構單元,其中4個碳原子位於正四面體的頂點,1個碳原子位於正四面體的中心。因為共價鍵難以變形,C-C鍵能大,所以金剛石硬度和熔點都很高,化學穩定性好。共價鍵中的電子被束縛在化學鍵中不能參與導電,所以金剛石是絕緣體,不導電。
金剛石結構的空間堆積率(又稱佔位比,為)比面心立方結構( )和六角密積結構(與長軸短軸比有關,近似與面心立方結構相同)低,也比體心立方結構( )低。但金剛石結構的原子密度(即單位空間中的原子數)大。這一特點對於金剛石尤其顯著,因為金剛石中的C-C鍵長很小。
金剛石結構與閃鋅礦結構(zincblende structure)非常相似,不同之處在於,構成閃鋅礦結構的兩個面心立方點陣上的原子是不同種類的,例如Zn和S, 而構成金剛石結構的原子是同種類的。閃鋅礦結構的堆積率隨兩種原子的相對大小而變。
金剛石與石墨同樣由碳原子構成,是同素異形體。由於碳原子的結合方式不同,兩種物質的性質迥異。石墨中的碳原子是按雜化的方式形成共價鍵的,在一個平面上以共價鍵結合成蜂窩狀結構,層與層之間靠比較弱的范德華力結合。同一層內碳原子之間的結合比金剛石還強,所以石墨的熔點比金剛石更高。但層間結合較弱,很容易發生滑移,所以硬度很低。石墨中碳原子的4個價電子中的3個形成共價鍵,另外一個價電子在晶體中形成大鍵,可以沿石墨層導電。
金剛石與其他的碳同素異型體之間的差別也是有碳原子結合方式的不同而引起的。
金剛石俗稱“金剛鑽”,也就是我們常說的鑽石,它是一種由純碳組成的礦物,也是自然界中最堅硬的物質。自18世紀證實了金剛石是由純碳組成的以後,人們就開始了對人造金剛石的研究,只是在20世紀50年代通過高壓研究和高壓實驗技術的進展,才獲得真正的成功和迅速的發展,人造金剛石亦被廣泛應用於各種工業,工藝行業。