蛋白質變性
蛋白質變性
蛋白質變性(protein denaturation)是指蛋白質分子中的醯氧原子核外電子,受質子的影響,向質子移動,相鄰的碳原子核外電子向氧移動,相對裸露的碳原子核,被親核加成,使分子變大,流動性變差。
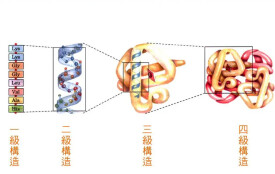
蛋白質是由多種氨基酸通過肽鍵構成的高分子化合物,在蛋白質分子中各氨基酸通過肽鍵及二硫鍵結合成具有一定順序的肽鏈稱為一級結構;蛋白質的同一多肽鏈中的氨基和醯基之間可以形成氫鍵或肽鏈間形成氫鍵,使得這一多肽鏈的主鏈具有一定的有規則構象,包括α-螺旋、β-摺疊、β-轉角和無規捲曲等,這些稱為蛋白質的二級結構;肽鏈在二級結構的基礎上進一步盤曲摺疊,形成一個完整的空間構象,稱為三級結構;多條肽鏈通過非共價鍵聚集而成的空間結構稱為四級結構,其中一條肽鏈叫一個亞基。

蛋白質變性
蛋白質的生物活性是指蛋白質所具有的酶、激素、毒素、抗原與抗體、血紅蛋白的載氧能力等生物學功能。生物活性喪失是蛋白質變性的主要特徵。有時蛋白質的空間結構只要輕微變化即可引起生物活性的喪失。
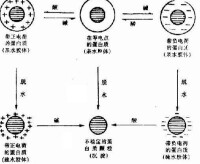
蛋白質分子凝聚從溶液中析出
蛋白質變性后,分子結構鬆散,不能形成結晶,易被蛋白酶水解。蛋白質的變性作用主要是由於蛋白質分子內部的結構被破壞。天然蛋白質的空間結構是通過氫鍵等次級鍵維持的,而變性后次級鍵被破壞,蛋白質分子就從原來有序的捲曲的緊密結構變為無序的鬆散的伸展狀結構(但一級結構並未改變)。所以,原來處於分子內部的疏水基團大量暴露在分子表面,而親水基團在表面的分佈則相對減少,至使蛋白質顆粒不能與水相溶而失去水膜,很容易引起分子間相互碰撞而聚集沉澱。
引起蛋白質變性的原因可分為物理和化學因素兩類。
物理因素可以是加熱、加壓、脫水、攪拌、振蕩、紫外線照射、超聲波的作用等;化學因素有強酸、強鹼、尿素、重金屬鹽、十二烷基硫酸鈉(SDS)等。
重金屬鹽使蛋白質變性,是因為重金屬陽離子可以和蛋白質中遊離的羧基形成不溶性的鹽,在變性過程中有化學鍵的斷裂和生成,因此是一個化學變化。
強酸、強鹼使蛋白質變性,是因為強酸、強鹼可以使蛋白質中的氫鍵斷裂。也可以和遊離的氨基或羧基形成鹽,在變化過程中也有化學鍵的斷裂和生成,因此,可以看作是一個化學變化。
尿素、乙醇、丙酮等,它們可以提供自己的羥基或羰基上的氫或氧去形成氫鍵,從而破壞了蛋白質中原有的氫鍵,使蛋白質變性。但氫鍵不是化學鍵,因此在變化過程中沒有化學鍵的斷裂和生成,所以是一個物理變化。
加熱、紫外線照射、劇烈振蕩等物理方法使蛋白質變性,主要是破壞蛋白質分子中的氫鍵,在變化過程中也沒有化學鍵的斷裂和生成,沒有新物質生成,因此是物理變化。否則,雞蛋煮熟后就不是蛋白質了。而我們知道,熟雞蛋依然有營養價值,其中的蛋白質反而更易為人體消化系統所分解吸收。
可促使蛋白質變性 *鹽析
1、雞蛋、肉類等經加溫后蛋白質變性,熟后更易消化。
2、細菌、病毒加熱,加酸、加重金屬(汞)因蛋白質變性而滅活(滅菌、消毒)。
3、動物、昆蟲標本固定保存、防腐。
4、很多毒素是蛋白質,加甲醛固定,減毒、封閉毒性鹼基團作類毒素抗原,製作抗毒素。
5、用於蛋白純化中雜蛋白的沉澱。
蛋白質在受到光照、熱、有機溶劑以及一些變性劑的作用時,次級鍵受到破壞,導致天然構象的破壞,使蛋白質的生物活性喪失。如果變性條件劇烈持久,蛋白質的變性是不可逆的。如果變性條件不劇烈,這種變性作用是可逆的,說明蛋白質分子內部結構的變化不大。這時,如果除去變性因素,在適當條件下變性蛋白質可恢復其天然構象和生物活性,這種現象稱為蛋白質復性(renaturation)。例如胃蛋白酶加熱至80~90℃時,失去溶解性,也無消化蛋白質的能力,如將溫度再降低到37℃,則又可恢復溶解性和消化蛋白質的能力。