肽鍵
肽鍵
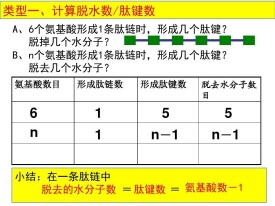
氨基酸通過肽鍵連接形成肽。
一分子氨基酸的α-氨基與另一分子氨基酸的α-羧基脫水縮合形成的共價鍵(—CO—NH—)稱為肽鍵( peptide bond)。兩分子氨基酸縮合成為二肽,二肽仍有自由α-氨基和α-羧基,能同樣借肽鍵與其他氨基酸縮合成三肽,相同的反應可繼續進行,依次形成四肽、五肽…...通常由10個以內氨基酸連成的肽稱為寡肽( oligopeptide);更多的氨基酸可連成多肽( polypeptide),氨基酸相互連接,形成長鏈,稱為多肽鏈(polypeptide chain)。
由一個氨基酸的羧基與另一個氨基酸的氨基脫水縮合而形成的化學鍵,稱為醯胺鍵,寫作—CO—NH一,又稱為肽鍵。
肽鍵的特點為:
1. 氮原子上的孤對電子與羰基具有明顯的共軛作用。
2. 肽鍵中的C—N鍵的鍵長比C=N鍵長,比相鄰的C一N單鍵短;肽鍵中的C一N鍵具有部分雙鍵性質,不能自由旋轉。
3. 組成肽鍵的四個原子處於同一平面。

肽鍵
4. 在大多數情況下,肽鍵是以反式結構存在的。
多肽分子中構成多肽鏈的基本化學鍵是肽鍵,肽鍵與相鄰的兩個碳原子所組成的基團(—C—CO—NH—C—)稱為肽單元。肽鏈就是由許多肽單元連接而成的,它們構成多肽鏈的主鏈骨架。通過對一些簡單的肽和蛋白質肽鍵的X射線晶體衍射法分析,證明肽單元的空間結構具有以下3個顯著的特徵:
1. 肽單元是平面結構。組成肽單元的6個原子位於同一平面內,形成一個肽鍵的平面結構,稱為肽鍵平面。
2. 肽鍵具有局部雙鍵性質,不能自由旋轉。肽鍵中的C一N鍵長為0.132nm,比相鄰的C一N單鍵(0.147nm)短,而較一般的C=N(0.127nm)長,介於兩者之間。這表明羰基的x電子發生離域現象,使肽鍵局部具有雙鍵性質,因此C一N之間的旋轉受到一定的阻礙。
3. 肽鍵呈反式構型。由於肽鍵不能自由旋轉,肽鍵平面上各原子可出現順反異構現象,與C一N鍵相連的O與H或兩個C。原子之間一般呈較穩定的反式構型。
肽鍵平面中除C一N鍵不能旋轉外,兩側的C一N和C一C。鍵均為鍵,因而相鄰的肽鍵平面可圍繞C。旋轉,肽鏈的主鏈骨架也可視為由一系列通過C。原子銜接的肽鍵平面所組成。肽鍵平面的旋轉所產生的立體結構可呈現多種狀態,從而導致蛋白質分子呈各種不同的構象。
天然存在的肽分子大小不等,有些是蛋白質降解的片斷,有些是具有特殊的生理和藥理作用的活性物質。就目前所知的多肽而言,多數是開鏈肽,少數為分支開鏈肽,環狀的多肽則非常少見。肽的化學性質在某些方面與氨基酸類似,而各種氨基酸殘基的R基團則對肽的性質有較大影響。肽與氨基酸一樣,也含有一COO和一NH等酸性和鹼性基團,因此也以偶極離子形式存在,具有各自的等電點。在水溶液中的酸鹼性質,主要取決於側鏈可電離的R基團的數目和性質。
由一氨基酸的羧基與另一氨基酸的氨基脫去一分子水形成的醯氨鍵又稱為肽鍵。
肽鍵具有特殊性質。從鍵長看,肽鍵鍵長(0.132nm)介於C—N單鍵(0.146nm)和雙鍵(0.124mm)之間,具有部分雙鍵的性質,不能自由旋轉;從鍵角看,肽鍵中鍵與鍵的夾角均為120°。因此,與肽鍵相連的6個原子(Cn、C、O、N、H、Ca)始終處在同一平面上,構成剛性的“肽鍵平面”( peptide bond plane),又稱“醯胺平面”或肽單元( peptide unit)。肽單元中,與C—N相連的氫和氧原子與兩個碳原子呈反向分佈。
蛋白質分子內的肽鍵主要是在氨基酸的C—位上形成許多個氨基酸單位以肽鍵連接即成為多肽鏈。肽鍵是蛋白質結構中的主要化學鍵;實際上多肽鏈就是蛋白質的基本骨架。
由於肽鍵中的原子處於共振狀態,所以肽鍵具有高度穩定性在肽鍵中,C一N單鍵具有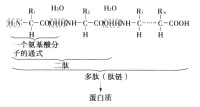 約40%雙鍵性質,C=O雙鍵也具有約40%單鍵性質。由此產生了兩個重要的結果:①肽鍵的亞氨基(NH)在pH0~14的範圍內沒有明顯的解離或質子化的傾向;②肽鍵中的C―N鍵具有雙鍵性質,不能自由旋轉,從而使組成肽鍵的原子大致固定在一個平面上,常稱為“肽鍵平面”,對於限制多肽鏈的構象數目起著重要作用。
約40%雙鍵性質,C=O雙鍵也具有約40%單鍵性質。由此產生了兩個重要的結果:①肽鍵的亞氨基(NH)在pH0~14的範圍內沒有明顯的解離或質子化的傾向;②肽鍵中的C―N鍵具有雙鍵性質,不能自由旋轉,從而使組成肽鍵的原子大致固定在一個平面上,常稱為“肽鍵平面”,對於限制多肽鏈的構象數目起著重要作用。

肽鍵
最簡單的肽是由兩個氨基酸組成的二肽,其中含有一個肽鍵;含有三個、四個、五個等氨基酸殘基的肽分別稱為三肽、四肽、五肽等。肽鏈中的氨基酸由於形成肽鍵已經不是完整的分子,因此稱為氨基酸殘基。一般稱多肽鏈有自由氨基的一端為肽鏈的氨基末端或N端;稱有自由羧基的另一端為肽鏈的羧基末端或C端,肽的命名是根據其組成氨基酸殘基確定的,通常從肽鏈的N端開始,例如,下列的五肽可命名為絲氨醯甘氨醯酪氨醯丙氨醯亮氨酸。
肽鏈中的自由氨基、羧基及殘基側鏈的其它基團可發生與氨某酸中相應基團相類似的化學反應。N端氨基酸殘基也能與茚三酮發生呈色反應。雙縮脲反應通常是用以測量肽和蛋白質的種顏色反應:一般含兩個或更多肽鍵的化合物即可與鹼性CuSO溶液生成紫紅色或藍紫色的複合物,稱為雙縮脲反應。利用這個反應可測定蛋白質的含量。應用雙縮脲反應、紅外光譜分析及X線衍射法等均可證明蛋白質分子中肽鍵的存在,蛋白質分子中的多肽鏈可被酸、鹼或蛋白酶水解成為氨基酸或分子較小的肽段,此方法在研究蛋白質的一級結構時常被採用。
除了蛋白質部分水解可以產生各種簡單的肽之外自然界還有各種長短不等的肽類物質存在,它們具有各種特殊的生理功能。谷胱甘肽(Y谷氨醯半胱氨醯甘氨酸)是廣泛存在的一種三肽,因其含有SH基,常以GSH表示。此三肽可能在體內氧化還原過程中起重要作用。
此外許多激素,如催產素、加壓素、舒緩激肽、腦啡肽等都是多肽。還有一種環狀多肽是由開鍵多酞的末端氨基與末端羧基縮合形成肽鍵產生的,如抗菌素、短桿菌肽就是一個環十肽。
醯胺鍵(—CO—N—)中的C和N原子均為sp雜化,具有平面結構,氮原子上的孤對電子與羰基之間形成p—π共軛體系。由於N原子上電子對的離域化,CN鍵的鍵長比胺中C—N鍵的鍵長要短,具有部分雙鍵的性質。另外,氧的吸電子作用也使氮上電子云密度降低,從而使氮的鹼性減弱。
肽鍵是由一個氨基酸的羧基與另一個氨基酸的氨基脫水縮合而形成的化學鍵,也稱為醯胺鍵,寫作—CO—NH一。肽鍵都是醯胺鍵,醯胺鍵包括肽鍵但不等同於肽鍵。醯胺鍵所指的範圍比肽鍵的大。