蛋白質分子
蛋白質分子
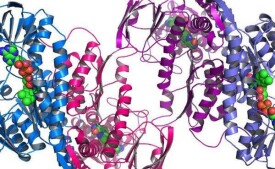
蛋白質分子內各個原子之間相互的立體關係就是蛋白質分子的結構。通常將蛋白質的結構分為一級結構、二級結構、三級結構和四級結構。
2.蛋白質的二級結構:蛋白質的二級結構是指蛋白質分子中多肽鏈本身的摺疊方式。近年來,通過研究知道,蛋白質分子的多肽鏈本身一般都不是全部以鬆散的線性分子的狀態存在於生物體內,而是部分捲曲盤旋成螺旋狀(一般呈所謂α螺旋),或摺疊成片層狀(又稱β摺疊),或呈β回折(髮夾回折、U形轉折),或呈無規則捲曲。蛋白質的二級結構主要依靠氫鍵來維持結構的穩定性。
3.蛋白質的三級結構:具有二級結構的肽鏈,按照一定方式再進一步捲曲、盤繞、摺疊成一種看來很不規則,而實際上有一定規律性的三維空間結構,叫做三級結構。這些肽鏈所以會捲曲、盤繞、摺疊,主要是因為肽鏈的氨基酸側鏈之間的相互作用。
4.蛋白質的四級結構:具有三級結構的蛋白質分子,通過一些非共價鍵結合起來,而成為具有生物功能的蛋白質大分子,就是蛋白質的四級結構。構成功能單位的每條肽鏈,稱為亞基。亞基雖然具有二、三級結構,但是在單獨存在時並沒有生物活力,只有完整的四級結構才具有生物活力。例如,磷酸化酶是由兩個亞基構成的,馬血紅蛋白是由四個不同的亞基(2個α肽鏈,2個β肽鏈)構成的,谷氨酸脫氫酶是由六個相同的亞基構成的。
有些蛋白質分子只有一、二、三級結構,並無四級結構,如肌紅蛋白、細胞色素c、核糖核酸酶、溶菌酶等。另一些蛋白質,則一、二、三、四級結構同時存在,如血紅蛋白、谷氨酸脫氫酶等。
蛋白質分子
分子量為6103~106,其元素組成除含碳、氫、氧外,均含氮和少量硫。蛋白質的結構很複雜,多肽鏈內的多種α—氨基酸以一定順序排列,肽鏈上不直接相連的氨基之間通過特殊的分子間力(氫鍵)結合、盤旋、疊合呈空間結構,因此蛋白質是以多種氨基酸為單體的高聚醯胺。蛋白質種類繁多,水解產物均是α—氨基酸的稱為單純蛋白質。
單純蛋白質與非蛋白質的結合物叫結合蛋白,如脂蛋白、糖蛋白、血紅蛋白等。單純蛋白質又可分為不溶於水的纖維蛋白,如毛髮、絲、爪甲等;可溶於水的球蛋白,如血清蛋白、酶等。研究蛋白質的組成、結構和合成,進一步探索生命現象,是科學研究的重要課題。1965年我國科學家在世界上第一次用人工方法合成了具有生命活力的蛋白質—結晶牛胰島素。
蛋白質分子
蛋白質是人類生活中不可缺少的物質。人類食用蛋白質的70%來自糧食作物。農業科研工作中一項重要的任務是通過育種工作更多地培育出蛋白質含量高的優良品種。許多蛋白質可作藥物,如胰島素、干擾素、免疫球蛋白等等。許多疾病與蛋白質分子病變有關,如鐮刀型紅細胞貧血症就是由於血紅蛋白分子上某個氨基酸發生變異而引起的。儀器製造、酶製劑生產以及絲綢和皮革生產都與蛋白質直接有關。80年代興起的蛋白質工和將使人們可以按意願設計並定向製造出新型的蛋白質以造福於人類。
蛋白質分子
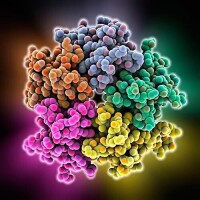
1912年英國布喇格父子建立了X射線晶體學,成功地測定了一些相當複雜的分子以及蛋白質的結構。以後布喇格的學生阿斯特伯里和貝爾納又分別對毛髮、肌肉等纖維蛋白以及胃蛋白酶、煙草花葉病毒等進行了初步的結構分析。他們的工作為後來生物大分子結晶學的形成和發展奠定了基礎。
20世紀50年代是分子生物學作為一門獨立的分支學科脫穎而出並迅速發展的年代。首先在蛋白質結構分析方面,1951年提出了α-螺旋結構,描述了蛋白質分子中肽鏈的一種構象。1955年桑格完成了胰島素的氨基酸序列的測定。接著肯德魯和佩魯茨在X射線分析中應用重原子同晶置換技術和計算機技術,分別於1957和1959年闡明了鯨肌紅蛋白和馬血紅蛋白的立體結構。1965年中國科學家合成了有生物活性的胰島素,首先實現了蛋白質的人工合成。
另一方面,德爾布呂克小組從1936年起選擇噬菌體為對象開始探索基因之謎。噬菌體感染寄主後半小時內就複製出幾百個同樣的子代噬菌體顆粒,因此是研究生物體自我複製的理想材料。
1940年比德爾和塔特姆提出了“一個基因,一個酶”的假設,即基因的功能在於決定酶的結構,且一個基因僅決定一個酶的結構。但在當時基因的本質並不清楚。1944年埃弗里等研究細菌中的轉化現象,證明了DNA是遺傳物質。
遺傳密碼的闡明則揭示了生物體內遺傳信息的貯存方式。1961年雅各布和莫諾提出了操縱子的概念,解釋了原核基因表達的調控。到20世紀60年代中期,關於DNA自我複製和轉錄生成RNA的一般性質已基本清楚,基因的奧秘也隨之開始解開了。
僅僅三十年左右的時間,分子生物學經歷了從大膽的科學假說,到經過大量的實驗研究,從而建立了本學科的理論基礎。進入70年代,由於重組DNA研究的突破,基因工程已經在實際應用中開花結果,根據人的意願改造蛋白質結構的蛋白質工程也已經成為現實。
蛋白質分子
(1)蛋白質(包括酶)的結構和功能。
(2)核酸的結構和功能,包括遺傳信息的傳遞。
(3)生物膜的結構和功能。
(4)生物調控的分子基礎。
(5)生物進化。