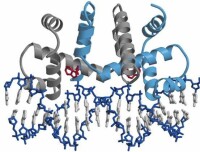
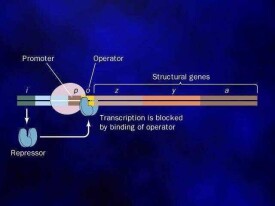
操縱子
核苷酸序列
操縱組又稱操縱子或操縱元,是指一組關鍵的核苷酸序列,包括了一個操縱基因,一個普通的啟動子,及一個或以上的結構基因被用作生產信使RNA的基元。操縱子主要在原核生物及線蟲動物門出現。它們是由方斯華·賈克柏及賈克·莫諾於1961年所發現。
操縱子(operon):指包含結構基因、操縱基因以及啟動基因的一些相
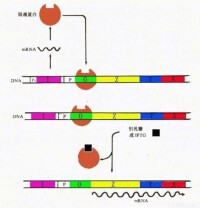
操縱子
阿拉伯糖操縱子 ara operon
阿拉伯糖操縱子是指令合成糖分解代謝所需酶系的操縱子,它具有正、負調節的功能。
阿拉伯糖的代謝是由araB、araA和araD基因所編碼的三種酶的催化的。其特點是:
⑴AraC蛋白是雙功能的,單純的araC蛋白結合於araO1(-100~-144)(操縱基因),起到阻遏的作用;當araC蛋白和誘導物Ara結合形成的複合體是Cind(CinducedPro.誘導型araC蛋白),它結合於araI區(-40~-78)使RNA Pol(RNA聚合酶)結合於PBAD位點(+140),轉錄araB、araA、araD三個基因;
⑵C蛋白結合araO1時也反饋性地阻遏了其本身的表達;
⑶araC蛋白的兩種狀態(Cind和Crep)功能不同,結合的位點也不同Cind結合於araI
Crep(Crepressionprotein阻遏型araC蛋白)可結合於araO1和araO2;
⑷ara操縱子的araC蛋白還可以調節分散的基因araE和araF,因此,轉錄單位也稱調節子(regulon);
⑸本操縱子有兩個啟動子Pc和PBAD,可以雙向轉錄;
⑹Pc啟動子和araO1重疊。
當Glu(葡萄糖)和Ara(阿拉伯糖)都存在時,araC蛋白基因轉錄,產生少量的C蛋白,結合於araO1(-106~-144),使RNA聚酶不能結合PC啟動子,使araC的轉錄受到阻遏。
當有Ara存在,而沒有Glu時,Ara可作為糖源。此時Ara和少量的araC蛋白結合形成了誘導型的araC蛋白—Cind,它作為正調控因子結合於araI,促進了araPBAD的轉錄,產生了araB、araA、araD 3種酶,促使Ara分解;
當Ara不存在或者用過完了,過量的araC蛋白可以結合則araO1上,阻礙RNA聚合酶在此區域結合,從而關閉了操縱子;或者結合到araI(-40~-78)和araO2上,彼此相互作用形成了環,阻遏了PBAD和PC的啟動。
乳糖操縱子包括調節基因、啟動子、操縱區和結構基因。
乳糖操縱子(lac操縱子)
大腸桿菌的lac操縱子受到兩方面的調控:一是對RNA聚合酶結合到啟動子上的調控(正調控);二是對操縱基因的調控(負調控)。
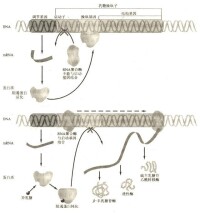
操縱子
在含乳糖的培養基中加入葡萄糖時,不能利用乳糖的原因是:在lac操縱子的調控中,有降解物基因活化蛋白(CAP),當它特異地結合在啟動子上時,能促進RNA聚合酶與啟動子結合,促進轉錄(由於CAP的結合能促進轉錄,稱為陽性調控方式)。但遊離的CAP不能與啟動子結合,必須在細胞內有足夠的cAMP時,CAP首先與cAMP形成複合物,此複合物才能與啟動子相結合。葡萄糖的降解產物能降低細胞內cAMP的含量,當向乳糖培養基中加入葡萄糖時,造成cAMP濃度降低,CAP便不能結合在啟動子上。此時即使有乳糖存在,RNA聚合酶不能與啟動子結合,雖已解除了對操縱基因的阻遏,也不能進行轉錄,所以仍不能利用乳糖。
色氨酸操縱子的基本結構
色氨酸操縱子
大腸桿菌色氨酸操縱子結構較簡單,也是研究得最清楚的操縱子,結構基因依次排列為trpE,trpD,trpC,trpB,trpA,其中trpG與trpD 和trpC與trpF分別發生基因融合。trpE和trpG編碼鄰氨基苯甲酸合酶,trpD編碼鄰氨基苯甲酸磷酸核糖轉移酶,trpC編碼吲哚甘油磷酸合酶,trpF編碼異構酶,trpA和trpB分別編碼色氨酸合酶的α和β亞基。trpE的上游為調控區,由啟動子、操縱基因和162bp 的前導序列組成。5 個結構基因全長約6800bp,trpD遠側還有一個二級啟動子,在細胞生長需要過量Trp時發揮作用。
一些G+菌,如枯草桿菌色氨酸操縱子的結構有所不同,7 個結構基因中的6 個依次排列為trpE,trpD,trpC,trpF,trpB,trpA,存在於含有12個結構基因的芳香族氨基酸超操縱子( aro operon ),第7 個結構基因,trpG存在於葉酸合成操縱子中,該酶參與Trp 和葉酸的合成。有2個啟動子參與調控,一個位於aro operon的起始位置,另一個則位於trpE 上游約200 bp處。
色氨酸操縱子的調控作用途徑
Trp合成途徑較漫長,消耗大量能量和前體物,如絲氨酸、PRPP(5-磷酸核糖-1-焦磷酸)、谷氨醯氨等,是細胞內最昂貴的代謝途徑之一,因此受到嚴格調控,其中色氨酸操縱子發揮著關鍵作用。調控作用主要有三種方式:阻遏作用、弱化作用以及終產物Trp 對合成酶的反饋抑制作用。
阻遏作用
trp操縱子轉錄起始的調控是通過阻遏蛋白實現的。產生阻遏蛋白的基因是trpR,該基因距trp operon基因簇很遠。它結合於trp 操縱基因特異序列,阻止轉錄起始。但阻遏蛋白的DNA結合活性受Trp調控,Trp起著一個效應分子的作用,Trp與之結合的動力學常數為1~2 ×10- 5mol·L - 1。在有高濃度Trp存在時,阻遏蛋白- 色氨酸複合物形成一個同源二聚體,並且與色氨酸操縱子緊密結合,因此可以阻止轉錄。阻遏蛋白- 色氨酸複合物與基因特異位點結合的能力很強,動力學常數為2 ×10- 10mol·L - 1,因此細胞內阻遏蛋白數量僅有20~30分子已可充分發揮作用。當Trp 水平低時,阻遏蛋白以一種非活性形式存在,不能結合DNA。在這樣的條件下,trp操縱子被RNA聚合酶轉錄,同時Trp 生物合成途徑被激活。
弱化作用
trp操縱子轉錄終止的調控是通過弱化作用( attenuation)實現的。在大腸桿菌trp operon,前導區的鹼基序列包括4個分別以1、2、3和4表示的片段,能以兩種不同的方式進行鹼基配對,1 - 2和3 -4配對,或2 - 3配對,3 - 4配對區正好位於終止密碼子的識別區。前導序列有相鄰的兩個色氨酸密碼子,當培養基中Trp 濃度很低時,負載有Trp 的tRNATrp也就少,這樣翻譯通過兩個相鄰色氨酸密碼子的速度就會很慢,當4區被轉錄完成時,核糖體滯留1區,這時的前導區結構是2 - 3配對,不形成3 - 4配對的終止結構,所以轉錄可繼續進行。反之,核糖體可順利通過兩個相鄰的色氨酸密碼子,在4區被轉錄之前,核糖體就到達2區,這樣使2 - 3不能配對,3 - 4 區可以配對形成終止子結構,轉錄停止。
枯草桿菌的弱化作用機制另有特點。因其色氨酸操縱子結構的特殊性,轉錄起始的調節似乎不如轉錄終止的調節更具重要性。枯草桿菌色氨酸操縱子表達主要受到色氨酸激活RNA結合蛋白( Trp -activated RNA - binding p rotein,TRAP)的調節。該蛋白與色氨酸結合被激活后,可與trpE上游轉錄產物結合,導致轉錄終止。當色氨酸濃度較低時,TRAP失活,轉錄可以繼續,結構基因得以表達。另外枯草桿菌對未負荷色氨酸的tRNATrp也很敏感,後者大量堆積,會誘導合成抗TRAP 蛋白( anti -TRAP,AT)。AT與Trp激活的TRAP結合,可以取消其轉錄終止活性。trpG表達也受TRAP調控,活化的TRAP與和trpG相重疊的S - D 序列結合,阻礙核糖體的結合,抑制trpG轉錄。
反饋抑制作用
由於基因表達必然消耗一定的能源和前體物,相對於阻遏和弱化作用,反饋抑制作用更為經濟和高效。終產物Trp對催化分支途徑幾步反應的酶具有反饋抑制作用,其50%抑制濃度分別為:鄰氨基苯甲酸合酶,0. 0015 mmol·L - 1 ;鄰氨基苯甲酸磷酸核糖轉移酶,0. 15 mmol·L - 1 ; 色氨酸合成酶,7. 7mmol·L - 1。對於普通野生菌株,鄰氨基苯甲酸合酶對Trp合成起到關鍵調控作用,常被稱為瓶頸酶;但對高產Trp工程菌而言,上述任何一種酶的反饋抑制都會直接影響Trp產量。研究發現酶蛋白某些特殊位點突變可以導致對反饋抑制作用敏感性顯著下降,如鄰氨基苯甲酸合酶38位的絲氨酸被精氨酸取代,抗反饋抑制能力顯著提高,當環境中Trp濃度為10 mmol·L - 1時酶活性不受影響,而相同條件下野生型酶活性不到1%。鄰氨基苯甲酸磷酸核糖轉移酶162位纈氨酸被谷氨酸取代,抗反饋抑制能力也有顯著提高,當環境中含有0. 83 mmol·L - 1色氨酸或0. 32 mmol·L - 1 5 - 甲基- 色氨酸時,酶活性分別為野生菌的3. 6倍和2. 4倍。陳小芳等報道一株谷氨酸棒桿菌鄰氨基苯甲酸合酶基因7個鹼基突變導致6個氨基酸殘基改變,抗反饋抑制能力顯著增強,環境中Trp 濃度達到15 mmol·L - 1時,鄰氨基苯甲酸合酶活性幾乎沒有變化。
色氨酸操縱子遺傳改造
由於色氨酸操縱子的調控作用,自然界不可能存在高產Trp菌株,為了獲得高產Trp菌株,就必須對色氨酸操縱子進行改造,解除其調節作用。早期的研究策略主要依靠傳統誘變方法,經過長期努力,獲得了一些有價值的研究結果,如獲得了TrpR - 菌株,通過缺失某些片斷解除了弱化作用,得到了一些抗反饋抑制的酶。許多Trp生產菌株都是通過隨機的誘變技術篩選得到的,如王健等通過硫酸二乙酯誘變,Trp 類似物篩選等方法從谷氨酸棒桿菌中培育出一株trp 高產菌株,搖瓶發酵64 h,產trp達到7. 28 g·L - 1。
傳統誘變的方法儘管有效,但其缺陷點也是顯而易見的,如工作量大,效率低,突變株的菌體生長、對環境的耐受性以及遺傳穩定性等都比野生型菌株差等。基因工程技術的建立和發展對色氨酸操縱子改造提供了新的技術平台。1979年Tribe等人採用DNA重組技術對大腸桿菌進行改造,擴增trp 操縱子,發酵12 h,產酸1 g·L - 1,產酸量儘管不是很高,但是其意義卻十分重大,由此開創了基因工程技術在Trp生物合成應用的先河。隨後,Aiba等將帶有色氨酸操縱子的質粒引入大腸桿菌,發酵27 h,並補充鄰氨基苯甲酸,得到trp 6. 2 g·L - 1。Ikeda等通過構建穩定質粒,擴增分支途徑限速酶並改造中心代謝途徑,獲得產Trp 達58 mg ·L - 1 的菌株。除了擴增表達操縱子基因,對其進行理性設計和改造也開始引起關注。已知酶分子某些特殊位點突變可以導致對反饋抑制作用敏感性下降,因此可以考慮利用基因工程技術對色氨酸操縱子結構基因進行理性改造降低其對反饋抑制的敏感性,但是Z至今尚缺乏成功的範例,主要原因在於現有酶分子反饋抑制結構與功能關係資料不足,不能滿足需要。
代謝工程理論與色氨酸操縱子調控研究
1991年,Bailey用代謝工程描述利用DNA重組技術對細胞的酶反應、物質運輸以及調控功能的遺傳操作,進而改良細胞生物活性的過程,標誌著代謝工程向一門系統學科發展的轉折點。代謝工程亦稱途徑工程,以區別於傳統的單基因表達(第一代基因工程)和基因定向突變(第二代基因工程),是有目的地對細胞生化反應的代謝網路進行修飾的技術,在多基因水平上設計修飾細胞固有的代謝途徑和遺傳性狀,並賦予細胞更為優越甚至嶄新的產物生產品質。代謝工程在提高宿主細胞原有代謝物的產量、產生新物質、擴展和構建新代謝途徑、生產代謝產物如氨基酸、抗生素、維生素以及降解環境污染物等諸多方面顯示出廣闊的應用前景。從理論上提高Trp產率是代謝工程的首要任務,這需要對Trp生物合成和對細胞內控制Trp 代謝的異化途徑有很好的了解,同時還要有一個在較寬的微生物代謝網路內描述這些途徑的有效的數學模型。早期的模型主要考慮色氨酸操縱子動力學的某個方面,僅有少數研究模型,綜合考慮了色氨酸操縱子的三種作用機制。修志龍等將代謝工程理論引入trp代謝分析領域,建立了適宜的數學模型,發現在代謝穩定的條件下,阻遏水平和酶的反饋抑制強度嚴重地影響了目標變數,即trp 濃度。Santillan等人提出的動力模型採用Second Lyapunov’s method分析,通過對野生菌株和幾株改良菌株(鄰氨基苯甲酸合成酶反饋抑制和弱化作用分別解除)的性能進行比較、驗證,得出結論認為酶的反饋抑制對於系統穩定性具有重要作用,而弱化作用影響較小,主要在Trp營養發生改變時發生作用。這兩個模型有一定的代表性,它們考慮了酶的反饋抑制,對於Trp生物合成具有一定指導意義;但其不足也很明顯,僅僅考慮了鄰氨基苯甲酸合成酶的反饋抑制作用,對其它酶未作考慮,另外一個不足是缺乏高產色氨酸菌株來加以驗證。
操縱子包含一個或以上的結構基因,這個結構基因會被轉錄成為一個多基因性的mRNA。一個單一的mRNA分子會為多於一個蛋白質編碼。在結構基因上游的是啟動子序列,能給核糖核酸聚合酶(RNA聚合酶)提供結合位點及引發轉錄。在啟動子附近的是一組DNA稱為操縱基因。操縱子亦會包含調控基因,如阻遏基因能為調控蛋白質編碼,使之與操縱基因結合及阻止轉錄。調控基因未必是操縱子的一部份,但是位於基因組的某一處。阻遏基因會到達操縱基因阻礙結構基因的轉錄。 原核生物的一個轉錄區段可視為一個轉錄單位,也稱作操縱子。
主條目:啟動子
一個啟動子是一組DNA序列能使一個基因進行轉錄。啟動子是由RNA聚合酶所確認,並且引發轉錄。在RNA的合成中,啟動子是一種方法區分哪一個基因用作製造mRNA,及進而控制細胞製造哪一種蛋白質。
操縱基因是DNA的一節能調控與操縱子連結的結構基因的活動,這種調控是透過獨特阻遏基因或活躍基因的相互作用。這是一個調控過程將基因“關掉”或“開啟”。
控制操縱子基因是屬於基因調節的一種,能使生物調控不同基因對環境條件的表現。操縱子調節可以是負向或正向的。負向調節涉及與阻遏基因與操縱基因的結合,以阻止轉錄。
在負向可誘導操縱子中,一個調節的阻遏蛋白質一般會與操縱基因結合,並阻止操縱子中基因的轉錄。若存在著一個誘導物分子,它會與阻遏蛋白結合,並改變它的構造,使它不能與操縱基因結合。這可以使操縱基因的轉錄發生。
在負向可阻遏操縱子中,操縱子的基因轉錄一般都會發生。阻遏蛋白質會由調控基因所產生,但它們卻不能夠與操縱基因結合。但是,某些稱為共同抑制物的分子可以與阻遏蛋白質結合,並改變它的構造,使得它能與操縱基因結合。活躍化的阻遏蛋白質會與操縱基因結合,並阻止轉錄。
操縱子亦可以是正向調控的。當存在正向調控時,活躍基因會與DNA結合(一般是在非操縱基因的位點)而引發轉錄。
在正向可誘導操縱子中,活躍蛋白質一般不能與適切的DNA結合。但是,某些基底分子可以與活躍蛋白質結合,並改變它的構造,使之能與DNA結合及令轉錄進行。
在正向可阻遏操縱子中,活躍蛋白質一般都會與適切的DNA段結合。但是,某些分子可以與活躍基因結合,以阻止它與DNA的結合,從而阻止轉錄的發生。
操縱子的數量及組織可以從大腸桿菌的研究中得知。預測可以基於基因組序列。
其中一個方法是使用不同讀架中基因間的距離作為基因組中操縱子數量的主要預測工具。這個分隔只會改變讀架及確保讀數的效能。在操縱子開始及結束的地方有較長的延伸,一般可以是40-50鹼基對。
若考慮分子的機能類,操縱子的預測則更準確。細菌會團集它的讀架成單元,隱藏在蛋白質複合物、共同途徑、或分享的底物及運載物中。因此,若有著所有這些資料及數據,預測會更準確,但這實際上是一項艱深的工作。
基因調節網路
L-阿拉伯糖操縱子:另一種經廣泛研究,大腸桿菌的操縱子。
蛋白質生物合成
遺傳密碼
原核生物