配離子
應用於化學學科的概念
應用
由於配合物是電中性的,因此,外界離子的電荷總數和配離子的電荷總數相等,而符號相反,所以由外界離子的電荷可以推斷出配離子的電荷及中心原子的氧化值。例如, K4[Fe(CN)6]中,外界離子的電荷總數=4x(+1) = +4,所以配離子的電荷為 -4,可以推出中心原子鐵的氧化值為Fe( II)。
配位化合物的中心離子與配位體鍵合形成的具有一定空間構型和特性的複雜離子(或化學質點)即配合物的內界。
可能存在於配位化合物晶體中,也可能存在於溶液中。
帶正電荷的配離子稱配陽離子(coordination cation)。帶負電荷的配離子稱配陰離子(coordination anion)。
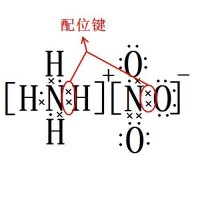
配離子由中心原子和配體組成。
配體(ligand,也稱為配基)是一個化學名詞,表示可和中心原子(金屬或類金屬)產生鍵結的原子、分子和離子。一般而言,配體在參與鍵結時至少會提供一個電子。配體扮演路易斯鹼的角色。但在少數情況中配體接受電子,充當路易斯酸。
分類
按配體中配位原子的多少,可將配體分為單齒配體和多齒配體。
單齒配體:一個配體中只有一個配位原子的配體。如 NH3、H20等。
兩可配體:有些配體雖然含有兩對孤對電子,但由於兩個配位原子靠得太近 ,每一配體只能選擇其中一個配 位原子與一個中心原子形成配鍵 ,這種配體稱為兩可配體 。 兩可配體仍屬單齒配體。
中心原子
又稱配位化合物的形成體或配位化合物的受體。
在某些特定情況下也可以是帶正電荷的非金屬離子。
中心離子(中心原子)的電荷與半徑影響配位化合物的穩定性。
配合物的中心原子一般是帶正電荷的陽離子,其中以過渡元素金屬離子居多,如鐵離子,銀離子等;少數高氧化值的非金屬元素的原子也可作為中心原子,如 中的B(III)等。而[Ni(Co)4] 、[Fe(Co)5]中的中心原子為Ni、Fe原子;[HCo(Co)4]中的中心原子是Co(- I )。
中心原子的判斷