電泳
化學反應
電泳(electrophoresis, EP)是電泳現象的簡稱,指的是帶電顆粒在電場作用下,向著與其電性相反的電極移動的現象。利用帶電粒子在電場中移動速度不同而達到分離的技術稱為電泳技術。
1807年,由俄國莫斯科大學的斐迪南·弗雷德里克·羅伊斯(Ferdinand Frederic Reuss)最早發現。
1936年瑞典學者A.W.K.蒂塞利烏斯設計製造了移動界面電泳儀 ,分離了血清白蛋白的3種球蛋白,創建了電泳技術。
在確定的條件下,帶電粒子在單位電場強度作用下,單位時間內移動的距離(即遷移率)為常數,是該帶電粒子的物理特徵性常數。不同帶電粒子因所帶電荷不同,或雖所帶電荷相同但荷質比不同,在同一電場中電泳,經一定時間后,由於移動距離不同而相互分離。分開的距離與外加電場的電壓與電泳時間成正比。
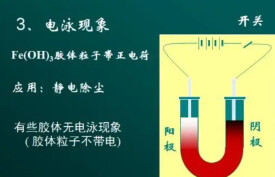
在外加直流電源的作用下,膠體微粒在分散介質里向陰極或陽極作定向移動,這種現象叫做電泳。利用電泳現象使物質分離,這種技術也叫做電泳。膠體有電泳現象,證明膠體的微粒帶有電荷。各種膠體微粒的本質不同,它們吸附的離子不同,所以帶有不同的電荷。
利用電泳可以確定膠體微粒的電性質,向陽極移動的膠粒帶負電荷,向陰極移動的膠粒帶正電荷。
一般來講,金屬氫氧化物、金屬氧化物等膠體微粒吸附陽離子,帶正電荷;非金屬氧化物、非金屬硫化物等膠體微粒吸附陰離子,帶負電荷。
例如,陶瓷工業中用的粘土,往往帶有氧化鐵,要除去氧化鐵,可以把粘土和水一起攪拌成懸浮液,由於粘土粒子帶負電荷,氧化鐵粒子帶正電荷,通電后在陽極附近會聚集出很純凈的粘土。工廠除塵也用到電泳。利用電泳還可以檢出被分離物,在生化和臨床診斷方面發揮重要作用。本世紀40年代末到50年代初相繼發展利用支持物進行的電泳,如濾紙電泳,醋酸纖維素膜電泳、瓊脂電泳;50年代末又出現澱粉凝膠電泳和聚丙烯醯胺凝膠電泳等。

電鑄電泳
電泳又名—— 電著(著),泳漆,電沉積。創始於二十世紀六十年代,由福特汽車公司最先應用於汽車底漆。由於其出色的防腐、防鏽功能,很快在軍工行業得到廣泛應用。近幾年才應用到日用五金的表面處理。由於其優良的素質和高度環保,正在逐步替代傳統油漆噴塗。
電泳漆膜具有塗層豐滿、均勻、平整、光滑的優點,電泳漆膜的硬度、附著力、
耐腐、衝擊性能、滲透性能明顯優於其它塗裝工藝。
詳細特點:
(1)採用水溶性塗料,以水為溶解介質,節省了大量有機溶劑,大大降低了大氣污染和環境危害,安全衛生,同時避免了火災的隱患;
(2)塗裝效率高,塗料損失小,塗料的利用率可達90%~95%;
(3)塗膜厚度均勻,附著力強,塗裝質量好,工件各個部位如內層、凹陷、焊縫等處都能獲得均勻、平滑的漆膜,解決了其他塗裝方法對復 雜形狀工件的塗裝難題;
(4)生產效率高,施工可實現自動化連續生產,大大提高勞動效率;
(5)設備複雜,投資費用高,耗電量大,其烘乾固化要求的溫度較高,塗料、塗裝的管理複雜,施工條件嚴格,並需進行廢水處理;
(6)只能採用水溶性塗料,在塗裝過程中不能改變顏色,塗料貯存過久穩定性不易控制。
(7)電泳塗裝設備複雜,科技含量較高,適用於顏色固定的生產。
是將被分離的離子(如陰離子)
混合物置於電泳槽的一端(如負極),在電泳開始前,樣品與載體電解質有清晰的界面。電泳開始后,帶電粒子向另一極(正極)移動,泳動速度最快的離子走在最前面,其他離子依電極速度快慢順序排列,形成不同的區帶。只有第一個區帶的界面是清晰的,達到完全分離,其中含有電泳速度最快的離子,其他大部分區帶重疊。
是在一定的支持物上,於均一的載體電解質中,將樣品加在中部位置,在電場作用下,樣品中帶正或負電荷的離子分別向負或正極以不同速度移動,分離成一個個彼此隔開的區帶。區帶電泳按支持物的物理性狀不同,又可分為紙和其他纖維膜電泳、粉末電泳、凝膠電泳與絲線電泳。
是將兩性電解質加入盛有pH梯度緩衝液的電泳槽中,當其處在低於其本身等電點的環境中則帶正電荷,向負極移動;若其處在高於其本身等電點的環境中,則帶負電向正極移動。當泳動到其自身特有的等電點時,其凈電荷為零,泳動速度下降到零,具有不同等電點的物質最後聚焦在各自等電點位置,形成一個個清晰的區帶,解析度極高。
是在樣品中加有領先離子(其遷移率比所有被分離離子的大)和終末離子(其遷移率比所有被分離離子的小),樣品加在領先離子和終末離子之間,在外電場作用下,各離子進行移動,經過一段時間電泳后,達到完全分離。被分離的各離子的區帶按遷移率大小依序排列在領先離子與終末離子的區帶之間。由於沒有加入適當的支持電解質來載帶電流,所得到的區帶是相互連接的(圖d),且因“自身校正”效應,界面是清晰的,這是與區帶電泳不同之處。
電泳分離原理示意圖 a 移動界面電泳b 區帶電泳 c 等電聚焦電泳 d 等速電泳L 領先離子T 終末離子。
電泳是電泳塗料在陰陽兩極,施加於電壓作用下,帶電荷的塗料離子移動到陰極,並與陰極表面所產生的鹼性物質作用形成不溶解物,沉積於工件表面。它包括四個過程:
泳動、遷移)陽離子樹脂及H+ 在電場作用下,向陰極移動,而陰離子向陽極移動過程。
(析出)在被塗工件表面,陽離子樹脂與陰極表面鹼性作用,中和而析出不沉積物,沉積於被塗工件上。
(脫水)塗料固體與工件表面上的塗膜為半透明性的,具有多數毛細孔,水被從陰極塗膜中排滲出來,在電場作用下,引起塗膜脫水,而塗膜則吸附於工件表面,而完成整個電泳過程。
生物大分子如蛋白質,核酸,多糖等大多都有陽離子和陰離子基團,稱為兩性離子。常以顆粒分散在溶液中,它們的靜電荷取決於介質的H+濃度或與其他大分子的相互作用。在電場中,帶電顆粒向陰極或陽極遷移,遷移的方向取決於它們帶電的符號,這種遷移現象即所謂電泳。
如果把生物大分子的膠體溶液放在一個沒有干擾的電場中,使顆粒具有恆定遷移速率的驅動力來自於顆粒上的有效電荷Q和電位梯度E。它們與介質的摩擦阻力f抗衡。在自由溶液中這種抗衡服從Stokes定律。
F=6πrvη
這裡v是在介質粘度為η中半徑為r的顆粒的移動速度。但在凝膠中,這種抗衡並不完全符合Stokes定律。F取決於介質中的其他因子,如凝膠厚度,顆粒大小,甚至介質的內滲等。
電泳遷移率(mbility)m規定為在電位梯度E的影響下,顆粒在時間t中的遷移距離d。
d
m= ------------ 或 m=V / E
t·E
遷移率的不同提供了從混合物中分離物質的基礎,遷移距離正比於遷移率。
1.電泳介質的pH值
溶液的pH值決定帶電物質的解離程度,也決定物質所帶凈電荷的多少。對蛋白質,氨基酸等類似兩性電解質,pH值離等電點越遠,粒子所帶電荷越多,泳動速度越快,反之越慢。因此,當分離某一種混合物時,應選擇一種能擴大各種蛋白質所帶電荷量差別的pH值,以利於各種蛋白質的有效分離。為了保證電泳過程中溶液的pH值恆定,必須採用緩衝溶液。
緩衝液的離子強度
溶液的離子強度(Ion intensity)是指溶液中各離子的摩爾濃度與離子價數平方的積的總和的1/2.帶電顆粒的遷移率與離子強度的平方根成反比。低離子強度時,遷移率快,但離子強度過低,緩衝液的緩衝容量小,不易維持pH恆定。高離子強度時,遷移率慢,但電泳譜帶要比低離子強度時細窄。通常溶液的離子強度在0.02~0.2之間。
I=1/2∑CiZi2 (I:離子強度;Ci:離子的摩爾濃度;Zi:離子價數. )
0.154M NaCl溶液的離子強度為:
I= 1/2(0.154×12+0.154×12)=0.154
0.015M Na2SO4溶液的離子強度為:
I= 1/2(0.015×2×12+0.015×22)=0.045
3.電場強度
電場強度(電勢梯度Electric field intensity)是指每厘米的電位降(電位差或電位梯度).電場強度對電泳速度起著正比作用,電場強度越高,帶電顆粒移動速度越快。根據實驗的需要,電泳可分為兩種:一種是高壓電泳,所用電壓在500~1000V或更高。由於電壓高,電泳時間短(有的樣品需數分鐘),適用於低分子化合物的分離,如氨基酸,無機離子,包括部分聚焦電泳分離及序列電泳的分離等。因電壓高,產熱量大,必須裝有冷卻裝置,否則熱量可引起蛋白質等物質的變性而不能分離,還因發熱引起緩衝液中水分蒸發過多,使支持物(濾紙,薄膜或凝膠等)上離子強度增加,以及引起虹吸現象(電泳槽內液被吸到支持物上)等,都會影響物質的分離。另一種為常壓電泳,產熱量小,室溫在10~25℃分離蛋白質標本是不被破壞的,無需冷卻裝置,一般分離時間長。
4.電滲現象
在電場中液體對於一個固體的固定相相對移動稱為電滲。在有載體的電泳中,影響電泳移動的一個重要因素是電滲。最常遇到的情況是γ-球蛋白,由原點向負極移動,這就是電滲作用所引起的倒移現象。產生電滲現象的原因是載體中常含有可電離的基團,如濾紙中含有羥基而帶負電荷,與濾紙相接觸的水溶液帶正電荷,液體便向負極移動。由於電滲現象往往與電泳同時存在,所以帶電粒子的移動距離也受電滲影響;如電泳方向與電滲相反,則實際電泳的距離等於電泳距離加上電滲的距離。瓊脂中含有瓊脂果膠,,其中含有較多的硫酸根,所以在瓊脂電泳時電滲現象很明顯,許多球蛋白均向負極移動。除去了瓊脂果膠后的瓊脂糖用作凝膠電泳時,電滲大為減弱。電滲所造成的移動距離可用不帶電的有色染料或有色葡聚糖點在支持物的中心,以觀察電滲的方向和距離。
對於不同的目的,應採用不同的檢測方法。用染料和生物大分子結合形成有色的複合物是電泳后檢測最常用的方法.
(七)聚丙烯醯胺凝膠電泳結果不正常現象和對策
1.指示劑前沿呈現兩邊向上或向下的現象。向上的“微笑”現象說明凝膠的不均勻冷卻,中間部分冷卻不好,所以導致凝膠中分子有不同的遷移率所致。這種情況在用較厚的凝膠以及垂直電泳中時常發生。向下的“皺眉”現象常常是由於垂直電泳時電泳槽的裝置不合適引起的,特別是當凝膠和玻璃板組成的“三明治”底部有氣泡或靠近隔片的凝膠聚合不完全便會產生這種現象。
2.“拖尾”現象是電泳中最常見的現象。這常常是由於樣品溶解不佳引起的,克服的辦法是在加樣前離心,選用合適的樣品緩衝液和凝膠緩衝液,加增溶輔助試劑。另一方法是降低凝膠濃度。
3.“紋理”現象常常是由於樣品中不溶顆粒引起的,克服辦法是增加溶解度和離心除去不溶性顆粒。
4.蛋白帶偏斜常常是由於濾紙條或電極放置不平行所引起的,或由於加樣位置偏斜而引起。
5.蛋白帶過寬,與鄰近蛋白泳道的蛋白帶相連,這是由於加樣量太多或加樣孔泄漏引起的。
6.蛋白帶模糊不清和分辨不佳是由於多種原因引起的。雖然梯度凝膠可以提高解析度,但與其他方法相比,常規聚丙烯醯胺凝膠電泳是解析度較低的方法。為了提高解析度,不要加過多的樣品,小體積樣品可給出窄帶。加樣后應立即電泳,以防止擴散。選擇合適的凝膠濃度,使組分得以充分的分離。通常靠近前沿的蛋白帶解析度不佳,所以應根據分子量與凝膠孔徑的關係,灌制足夠長度的凝膠,以使樣品不會走出前沿。樣品的蛋白水解作用也引起擴散而使解析度降低。水解作用通常發生在樣品準備的時候,系統中的內源性蛋白酶會水解樣品蛋白,如果在緩衝液中加蛋白酶抑製劑可以減少這種情況的發生。
電泳(Electrophoresis)是指帶電荷的粒子或分子在電場中移動的現象稱為電泳。大分子的蛋白質,多肽,病毒粒子,甚至細胞或小分子的氨基酸,核苷等在電場中都可作定向泳動.1937年Tiselius成功地研製了界面電泳儀進行血清蛋白電泳,它是在一U型管的自由溶液中進行的,電泳後用光學系統使各種蛋白所形成折光率差別成為曲線圖象,將血清蛋白分為白蛋白,α1-球蛋白,α2-球蛋白,β-球蛋白和γ-球蛋白五種,隨後,Wielamd 和Kanig 等於1948年採用濾紙條做載體,成功地進行了紙上電泳。從那時起,電泳技術逐漸被人們所接受並予以重視,繼而發展以濾紙,各種纖維素粉,澱粉凝膠,瓊脂和瓊脂糖凝膠,醋酸纖維素薄膜,聚丙烯醯胺凝膠等為載體,結合增染試劑如銀氨染色,考馬斯亮藍等大大提高和促進生物樣品著色與分辨能力,此外電泳分離和免疫反應相結合,使解析度不斷朝著微量和超微量(1ng~0.001ng)水平發展,從而使電泳技術獲得迅速推廣和應用。在此主要介紹常用電泳的一般原理及其應用。
所採用的電泳方法,大致可分為3類:顯微電泳,自由界面電泳和區帶電泳。區帶電泳應用廣泛,區帶電泳可分為以下幾種類型:
按支持物的物理性狀不同,區帶電泳可分為:
(1)濾紙為支持物的紙電泳;
(2)粉末電泳:如纖維素粉,澱粉,玻璃粉電泳;
(3)凝膠電泳:如瓊脂,瓊脂糖,硅膠,澱粉膠,聚丙烯醯胺凝膠電泳;
(4)緣線電泳:如尼龍絲,人造絲電泳
2.按支持物的裝置形式不同,區帶電泳可分為:
(1)平板式電泳:支持物水平放置,是最常用的電泳方式;
(2)垂直板電泳:聚丙烯醯胺凝膠可做成垂直板式電泳。
(3)柱狀(管狀)電泳:聚丙烯醯胺凝膠可灌入適當的電泳管中做成管狀電泳.
3.按pH的連續性不同,區帶電泳可分為:
(1)連續pH電泳:如紙電泳,醋酸纖維素薄膜電泳;
(2)非連續pH電泳:如聚丙烯醯胺凝膠盤狀電泳;
電泳所需的儀器有:電泳槽和電源。
1.電泳槽
電泳槽是電泳系統的核心部分,根據電泳的原理,電泳支持物都是放在兩個緩衝液之間,電場通過電泳支持物連接兩個緩衝液,不同電泳採用不同的電泳槽.常用的電泳槽有:
(1)圓盤電泳槽:有上,下兩個電泳槽和帶有鉑金電極的蓋。上槽中具有若干孔,孔不用時,用硅橡皮塞塞住.要用的孔配以可插電泳管(玻璃管)的硅橡皮塞。電泳管的內徑早期為5~7mm,為保證冷卻和微量化,現在則越來越細。
(2)垂直板電泳槽:垂直板電泳槽的基本原理和結構與圓盤電泳槽基本相同。差別只在於制膠和電泳不在電泳管中,而是在塊垂直放置的平行玻璃板中間。
(3)水平電泳槽:水平電泳槽的形狀各異,但結構大致相同。一般包括電泳槽基座,冷卻板和電極。
2. 電源
要使荷電的生物大分子在電場中泳動,必須加電場,且電泳的解析度和電泳速度與電泳時的電參數密切相關。不同的電泳技術需要不同的電壓,電流和功率範圍,所以選擇電源主要根據電泳技術的需要.如聚丙烯醯胺凝膠電泳和SDS電泳需要200~600V電壓。
1.聚丙烯醯胺凝膠電泳可用做蛋白質純度的鑒定.聚丙烯醯胺凝膠電泳同時具有電荷效應和分子篩效應,可以將分子大小相同而帶不同數量電荷的物質分離開,並且還可以將帶相同數量電荷而分子大小不同的物質分離開。其解析度遠遠高於一般層析方法和電泳方法,可以檢出10~10g的樣品,且重複性好,沒有電滲作用。
2.SDS聚丙烯醯胺凝膠電泳可測定蛋白質分子量。其原理是帶大量電荷的SDS結合到蛋白質分子上克服了蛋白質分子原有電荷的影響而得到恆定的荷/質比。SDS聚丙烯醯胺凝膠電泳測蛋白質分子量已經比較成功,此法測定時間短,解析度高,所需樣品量極少(1~100μg),但只適用於球形或基本上呈球形的蛋白質,某些蛋白質不易與SDS結合如木瓜蛋白酶,核糖核酸酶等,此時測定結果就不準確.
3.聚丙烯醯胺凝膠電泳可用於蛋白質定量。電泳后的凝膠經凝膠掃描儀掃描,從而給出定量的結果.凝膠掃描儀主要用於對樣品單向電泳后的區帶和雙向電泳后的斑點進行掃描。
4.瓊脂或瓊脂糖凝膠免疫電泳可用於①檢查蛋白質製劑的純度;②分析蛋白質混合物的組分;③研究抗血清製劑中是否具有抗某種已知抗原的抗體;④檢驗兩種抗原是否相同。