鈦鐵礦
提煉鈦的主要礦石
鈦鐵礦是鐵和鈦的氧化物礦物,是提煉鈦的主要礦石。鈦鐵礦很重,灰到黑色,具有一點金屬光澤。晶體一般為板狀,晶體集合在一起為塊狀或粒狀。成分為FeTiO3。含TiO252.66%,是提取鈦和二氧化鈦的主要礦物。三方晶系,中國四川攀枝花鐵礦中,鈦鐵礦分佈於磁鐵礦顆粒之間或裂理中,並形成大型礦床。鈦鐵礦的化學成分與形成條件有關。產於超基性岩、基性岩中的鈦鐵礦,MgO含量較高,基本不含Nb、Ta;鹼性岩中的鈦鐵礦,MnO含量較高,並含Nb、Ta;產於酸性岩中的鈦鐵礦,FeO、MnO含量均高,Nb、Ta含量亦相對較高。

鈦鐵礦
鈦鐵礦,常作為副礦物,或在基性、超基性岩中分散於磁鐵礦中成條片狀,與頑輝石、斜長石等共生。偉晶型鈦鐵礦,產於花崗偉晶岩中,與微斜長石、白雲母、石英、磁鐵礦等共生。鈦鐵礦往往在鹼性岩中富集。由於其化學性質穩定,故可形成沖積砂礦,與磁鐵礦、金紅石、鋯石、獨居石等共生。據晶形、條痕、弱磁性可與赤鐵礦或磁鐵礦區別。鈦鐵礦是最重要的鈦礦石礦物。
三方晶系,arh=0.553nm,α=54°49';Z=2。或ah=0.509nm,ch=1.407nm;Z=6。可視為剛玉型結構的衍生結構。不同點在於剛玉中Al的位置被Fe、Ti替換並相間排列而成,導致c滑移面消失,使空間群由R3c變為R3。
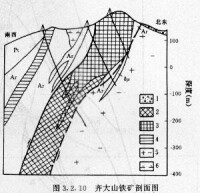
高溫下鈦鐵礦中的Fe、Ti呈無序分佈而具赤鐵礦結構(即剛玉型結構),故形成FeTiO3-Fe2O3固溶體,其組成可表示為Fe3O2-xFe2xTi4xO3(x代表鈦鐵礦的摩爾分數)。空間群從R3c轉變為R3的溫度為1100℃(x=0.65)至600℃(x=0.45)。當0.6>x≥0.5時,不能獲得完全有序的空間群為R3的結構;在x=0.5時,R3c到R3的轉變成亞穩定態,固溶體開始部分出溶。菱面體晶類。常呈不規則粒狀、鱗片狀或厚板狀。在950℃以上鈦鐵礦與赤鐵礦形成完全類質同象。當溫度降低時,即發生熔離,故鈦鐵礦中常含有細小鱗片狀赤鐵礦包體。鈦鐵礦顏色為鐵黑色或鋼灰色。條痕為鋼灰色或黑色。含赤鐵礦包體時呈褐色或帶褐的紅色條痕。金屬-半金屬光澤。不透明,無解理。硬度5~6.5,比重4~5。弱磁性。鈦鐵礦主要出現在超基性岩、基性岩、鹼性岩、酸性岩及變質岩中。我國攀枝花釩鈦磁鐵礦床中,鈦鐵礦呈粒狀或片狀分佈於鈦磁鐵礦等礦物顆粒之間,或沿鈦磁鐵礦裂開面成定向片晶。

鈦鐵礦
FeO47.36,TiO52.64。Fe2與Mg2、Mn2間可為完全類質同像代替,形成FeTiO3-MgTiO3或FeTiO3-MnTiO3系列。以FeO為主時稱鈦鐵礦,MgO為主時稱鎂鈦礦,MnO為主時稱紅鈦錳礦。常有Nb、Ta等類質同像替代。在>960℃的高溫條件下,FeTiO3-Fe2O3可形成完全固溶體。隨溫度下降,在約600℃,FeTiO3-Fe2O3固溶體出溶,在鈦鐵礦中析出赤鐵礦的片晶,並∥(0001)定向排列。結構與形態:
三方晶系,arh=0.553nm,α=5449';Z=2。或ah=0.509nm,ch=1.407nm;Z=6。可視為剛玉型結構的衍生結構。不同點在於剛玉中Al3的位置被Fe2、Ti4替換並相間排列而成,導致c滑移面消失,使空間群由R3c變為R3。
高溫下鈦鐵礦中的Fe、Ti呈無序分佈而具赤鐵礦結構(即剛玉型結構),故形成FeTiO3-Fe2O3固溶體,其組成可表示為Fe32-xFex2Tix4O3(x代表鈦鐵礦的摩爾分數)。空間群從R3c轉變為R3的溫度為1100℃(x=0.65)至600℃(x=0.45)。當0.6>x≥0.5時,不能獲得完全有序的空間群為R3的結構;在x=0.5時,R3cR3的轉變成亞穩定態,固溶體開始部分出溶。菱面體晶類。常呈不規則粒狀、鱗片狀或厚板狀。在950℃以上鈦鐵礦與赤鐵礦形成完全類質同象。當溫度降低時,即發生熔離,故鈦鐵礦中常含有細小鱗片狀赤鐵礦包體。鈦鐵礦顏色為鐵黑色或鋼灰色。條痕為鋼灰色或黑色。含赤鐵礦包體時呈褐色或帶褐的紅色條痕。金屬-半金屬光澤。不透明,無解理。硬度5~6.5,比重4~5。弱磁性。鈦鐵礦主要出現在超基性岩、基性岩、鹼性岩、酸性岩及變質岩中。我國攀枝花釩鈦磁鐵礦床中,鈦鐵礦呈粒狀或片狀分佈於鈦磁鐵礦等礦物顆粒之間,或沿鈦磁鐵礦裂開面成定向片晶。
鈦鐵礦主要為岩漿型和偉晶型。岩漿型鈦鐵礦,常作為副礦物,或在基性、超基性岩中分散於磁鐵礦中成條片狀,與頑輝石、斜長石等共生。偉晶型鈦鐵礦,產於花崗偉晶岩中,與微斜長石、白雲母、石英、磁鐵礦等共生。鈦鐵礦往往在鹼性岩中富集。由於其化學性質穩定,故可形成沖積砂礦,與磁鐵礦、金紅石、鋯石、獨居石等共生。據晶形、條痕、弱磁性可與赤鐵礦或磁鐵礦區別。鈦鐵礦是最重要的鈦礦石礦物。
鈦鐵礦
自然界中的鈦大部分處於分散狀態,主要形成礦物鈦鐵礦TeTiO3和金紅石TiO2,及釩鈦鐵礦等。我國四川攀枝花地區有極豐富的釩鈦鐵礦,儲量約15億噸。
那麼,鈦是怎樣被發現的呢?1791年,英國科學家格里戈爾在密那漢郊區找到一種礦石—黑色磁性砂,通過對這種礦石的研究,他認為礦石中有一種新的化學元素。並用發現礦石的地點“密那漢”命名這種新元素。
過了四年,德國化學家克拉普洛特從匈牙利布伊尼克的一種紅色礦石中,發現了這種新元素,他用希臘神話中“太旦”族的名字來命名(中文按它原文名稱的譯音,定名為鈦),克拉普洛特還特地指出,格里戈爾所發現的新元素“密那漢”就是鈦,但在當時找到的,實際上都是粉末狀的二氧化鈦而不是金屬鈦。直到1910年,美國化學家罕德爾才第一次製得純度達99.9%的金屬鈦,但總共不到1克。從發現鈦到製得金屬鈦,前後經歷了120年,到1947年,人們才開始在工廠里煉鈦,當時的年產量只有2噸。到了1955年,產量激增到2萬噸。到1972年,年產量達到20萬噸。鈦的用途越來越廣,日益受到人們的重視,人們稱它為未來的鋼鐵、21世紀的金屬。
鐵黑色或鋼灰色;條痕鋼灰色或黑色。含赤鐵礦包裹體時呈褐或褐紅色。金屬至半金屬光澤。不透明。無解理。有時出現或裂開。硬度5~ 5.5。性脆。相對密度4.0~5.0。具弱磁性。
偏光鏡下:深紅色,不透明或微透明。一軸晶。具非常高的折射率(N=2.7)和重摺率。

鈦鐵礦
在微波碳熱還原過程中,物料的溫度是逐步升高的。用微波將物料從室溫加熱至1123—1263K需要3—8min,實驗發現:鈦鐵礦的還原反應從一施加微波就開始進行,表明鈦鐵礦的微波碳熱還原反應即使在極低的溫度條件下就已開始進行。鈦鐵礦的這種特性,主要是一部分微波能會發生局域耦合共振,產生熱點。這些熱點的溫度比其他區域的溫度高得多,因而他們會產生化學反應,熱點的中心就是反應的中心。此外,原子或分子在反應中心還會發生激烈的振動,能更好地滿足化學反應的條件,這也會降低引發化學反應的溫度。正是由於有這些熱點的存在和分子或原子的激烈振動,鈦鐵礦的微波碳熱還原反應才可能在較低的溫度下進行,從而極大地降低鈦鐵礦碳熱還原過程的能耗。
鈦鐵礦的微波還原速率與樣品的含碳量關係十分密切。當樣品的初始含碳量小於20%時,還原速率隨著含碳量的增加而明顯加快;當含碳量大於20%時,進一步增加含碳量對還原速率沒有明顯的影響。
反應式:FeTiO3+C=Fe+TiO2+CO(1)FeTiO3+CO=Fe+TiO2+CO2(2)CO2+C=2CO(3)反應速率隨含碳量的增加而加快,當含碳量大於20%時,反應速率與含碳量無關。微波還原的速率比傳統還原快得多。據有關對鈦鐵礦進行微波碳熱還原和傳統碳熱還原研究的對比實驗表明:鈦鐵礦的微波還原速率比傳統還原快得多,在1153K時,微波碳熱還原的速率是傳統還原的79.06倍。微波還原在1153K的速率可以和傳統還原在1422K的速率相比較,兩者之間的溫度差高達269K,由此也表明,當用微波加熱代替傳統加熱時,鈦鐵礦的碳熱還原可以在較低的溫度下進行。
與鐵礦石的碳熱還原類似,鈦鐵礦的碳熱還原也是強烈的吸熱反應(ΔH=+181kJ/molFeTiO3,採用傳統加熱還原時同樣會產生“冷中心”。由於微波可以對物料進行快速的整體加熱,“冷中心”的問題自然得到解決,因而反應速率明顯加快。

鈦鐵礦
硫酸法可以使用較低品位的鈦鐵礦石,而且還可以生產硫酸亞鐵成本低廉,但是污染太大副產物難於處理消耗硫酸多;氯化法使用的礦石品位較高而且成本較高,但是污染小副產物較少而且氯可以循環使用。但是兩種方法都是將鈦礦變成純的二氧化鈦,然後將純的二氧化鈦與純氯和焦炭在高溫反應生成四氯化鈦和一氧化碳,最後用金屬鈣、鎂或者鈉將其還原成海綿狀的金屬鈦目前大規模生產鈦的方法:
第一步:在高溫時,將金紅石(TiO2)和炭粉(C)混合,並通入氯氣製得TiCl4和一種可燃性氣體CO。
第二步:在氬氣(Ar)環境中,用過量的鎂(Mg)在加熱條件下與TiCl4反應製得金屬鈦(氬氣不參加反應)
雲南是有色金屬王國,對有色金屬的開發自然比較重視,冶金技術日新月異,效率就是效益,該研究填補了鈦鐵礦微波還原的空缺,為工業利用微波碳熱還原鈦鐵礦提供了理論依據和方法指導。通過微波碳熱還原鈦鐵礦可以使反應速率加快,由於微波碳熱還原鈦鐵礦可以在較低的溫度下進行,所以能源的利用將大為降低,對於能源緊缺的中國來講無疑有很大的科學價值和經濟價值。相信該研究定會被應用於工業領域,產生很好的經濟和社會效益。

鈦鐵礦
由於鈦有這些優點,所以50年代以來,一躍成為突出的稀有金屬。鈦及其合金,首先用在製造飛機、火箭、導彈、艦艇等方面,目前開始推廣用於化工和石油部門。例如,在超音速飛機製造方面,由於這類飛機在高速飛行時,表面溫度較高,用鋁合金或不鏽鋼,在這種溫度下已失去原有性能而鈦合金在的550℃以上仍保持良好的機械性能,因此可用於製造超過音速3倍的高速飛機。這種飛機的用鈦量要佔其結構總重量的95%,故有“鈦飛機”之稱,目前,全世界約有一半以上的鈦,用來製造飛機機體和噴氣發動機的重要零件。鈦在原子能工業中,用於製造核反應堆的主要零件,在化學工業中,鈦主要用於製造各種容器、反應器、熱交換器、管道、泵和閥等。若把鈦加到不鏽鋼中,只加百分之一左右,就大大提高抗銹本領。
