水合物
水合物
水合物指的是含有水的化合物,其範圍相當廣泛。其中水可以以配位鍵與其他部分相連,如水合金屬離子,也可以是以共價鍵相結合,如水合三氯乙醛。也可以指是天然氣中某些組分與水分在一定溫度、壓力條件下形成的白色晶體,外觀類似緻密的冰雪,密度為0.88~0.90 g/cm3。研究表明,水合物是一種籠形晶體包絡物,水分子借氫鍵結合形成籠形結晶,氣體分子被包圍在晶格之中。
低分子的氣體的水合物為體心立方晶格,較大的氣體分子則是類似於金剛石的晶體結構。
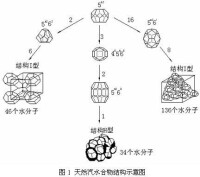
天然氣水合物結構
水合物化學式具有確定數目的水分子, 其結構大體可分為4類:
(1)全部H2O分子配位於金屬陽離子。例如, 六水合物Co(ClO4)2·6H2O中的6個H2O分子全部配位於Co2+離子, 可將其寫成[Co(H2O)6](ClO4)2。
(2)部分H2O分子配位於金屬陽離子,部分H2O分子鍵合於酸根陰離子。例如CuSO4·5H2O中的H2O分子。
(3)H2O分子進入固體晶格的確定位置,不與特定的陽離子或陰離子鍵合。這種化合物中的水分子叫晶格水,例如BaCl2·2H2O中的水分子。
(4)一部分H2O分子與陽離子配位,另一部分則是晶格水。明礬KAl(SO4)2·12H2O似乎具有這種結構。
最後還應該提到水合包合物。它們應該歸入水合物, 但卻不是從其組成離子的水溶液中結晶出來的化合物。它們是H2O分子彼此間通過氫鍵形成籠, 將外來的電中性分子或離子包於籠內而得到的一類水合物。例如Cl2(H2O)7.25 和“可燃冰”。
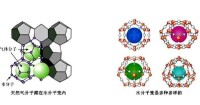
天然氣水合物
CuSO4· 5H2O按水分子的結合方式,其結構式可以寫成【Cu(H2O)4】 【SO4(H2O)】。許多其他水合硫酸鹽晶體如 FeSO4·7H2O、NiSO4·7H2O、ZnSO4·7H2O等,均有相同的結合方式。
在過渡金屬的水合物中,相同組成的水合物往往由於其中的水分子的結合方式不同而使其性質發生變化。例如無水三氯化鉻呈紅紫色;其水合物為暗綠色晶體,實驗式為CrCl3·6H2O。經實驗證明,6個水分子中只有4個水分子和 2個氯離子作為配體與鉻離子結合在內界【Cr(H2O)4Cl2】+, 不論在晶態或在水溶液中均穩定存在,因此,這種水合物的結構式可寫成【Cr(H2O)4Cl2】Cl·2H2O。如將暗綠色晶體的溶液冷卻至0℃以下並通入氯化氫HCl氣體,則析出紫色晶體,其結構式為【Cr(H2O)6】Cl3。將紫色晶體的溶液用乙醚處理並通以氯化氫氣體,就析出一種淡綠色晶體,其結構式為【Cr(H2O)5Cl】Cl2·H2O。三者的轉化表示如下:
水也可以不直接與陽離子或陰離子結合而依一定比例存在於晶體內,在晶格中佔據一定的部位。這種結合形式的水稱為晶格水,一般含有12個水分子。有些晶形化合物也含水,但無一定比例。例如沸石和其他硅酸鹽礦物。一些難溶的金屬氫氧化物實際上也是水合物。
(1)液態水的存在
液態水的存在是生成水合物的必要條件。
(2)低溫
低溫是形成水合物的重要條件,天然氣的溫度必須等於或低於天然氣中水汽的露點。
(3)高壓
組成相同的氣體,水合物生成溫度隨壓力升高(降低)而升高(降低)。
(4)其它條件
壓力的波動,氣流方向改變及微小水化晶的存在。
水合物的形成,堵塞井筒或採氣管線,影響氣井的正常生產,常用的防治水合物的方法有:
天然氣中含有水分是生成水合物的內在因素,因此,脫除天然氣的水分是杜絕水合物生成的根本途徑。
提高氣流溫度(加熱法)
提高溫度防止生成水合物的實質是把氣流溫度提高到生成水合物的溫度以上,加熱方法有蒸汽加熱法和水套爐加熱法。
向天然氣中加入各種能降低水合物生成溫度的天然氣水合物抑製劑,降低天然氣的露點,防止水合物的生成。
