原子半徑
原子半徑
原子半徑(Atomic Radius)是描述原子大小的參數之一。
根據不同的標度和測量方法,原子半徑的定義不同,常見的有軌道半徑,范德華半徑(也稱範式半徑),共價半徑,金屬半徑等。同一原子依不同定義得到的原子半徑差別可能很大,所以比較不同原子的相對大小時,取用的數據來源必須一致。
原子半徑主要受電子層數,核電荷數和最外層電子數三個因素影響。一般來說,電子層數越多,核電荷數越小,最外層電子數越多,原子半徑越大。這也使得原子半徑在元素周期表上有明顯的周期遞變性規律。
原子半徑對元素的化學性質有較大影響,所以對原子半徑的研究在化學的發展中有著極其重要的意義和價值。
影響原子半徑的因素有三個:一是核電荷數,核電荷數越多原子核對核外電子的引力越大(使電子向原核收縮),則原子半徑越小;當電子層數相同時,其原子半徑隨核電荷數的增加而減小;二是最外層電子數,最外層電子數越多半徑越大;三是電子層數(電子的分層排布與離核遠近空間大小以及電子云之間的相互排斥有關),電子層越多原子半徑越大。當電子層結構相同時,質子數越大,半徑越小。
原子半徑大小由上述一對矛盾因素決定。核電荷數增加使原子半徑縮小,而電子數增加和電子層數增加使原子半徑增加。當這對矛盾因素相互作用達到平衡時,原子就具有了一定的半徑。
我們只要比較上述這對矛盾因素相互作用的相當大小就不難理解
不同原子半徑大小的變化規律。
一.同周期原子半徑大小規律。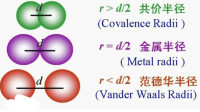

原子半徑
例如,比較鈉和鎂的半徑大小。
從鈉到鎂核電荷增加1個,其核對核外每一個電子都增加一定的作用力,原子趨向縮小,而核外電子也增加一個電子,因電子運動要佔據一定空間而使原子半徑趨向增加。實驗證明,鈉的原子半徑大於鎂,這說明增加的核電荷對原子半徑的縮小作用>增加的電子對原子半徑的增大作用。因此,同周期元素的原子從左到右逐漸減小(稀有氣體除外)。
二.相鄰周期元素原子半徑大小比較。
實驗結果鉀原子半徑>鈉原子半徑,這說明從鈉到鉀,增加的八個電子和增加的一個電子層對原子半徑的增大作用>增加的八個核電荷對原子半徑的縮小作用。所以,同主族元素的原子半徑從上到下逐漸增加。氖到鈉核電荷增加1個,核外電子和電子層均增加一個,由此推斷,鈉的半徑>氖的半徑,即:增加的一個電子和一個電子層對原子半徑的增加作用>增加的一個核電荷對原子半徑的縮小作用。值得注意的是,並不是電子層多的原子半徑就一定大,如:鋰原子半徑>鋁原子半徑。這是因為當核電荷增加到大於八以後,其核對半徑的縮小作用越來越強已經超過了增加一個電子層對半徑的增加作用。
例如,氯原子和氯離子半徑大小比較。
兩者核電荷相同而氯離子多一個電子,這一電子運動要佔據一定的空間,所以氯離子半徑>氯原子半徑。
原子及其陽離子半徑正好與上述相反。例如:鈉離子半徑<鈉原子半徑。
四.電子層結構相同而核電荷不同的粒子半徑大小比較。
因其核外電子層結構相同,顯然核電荷越多核對核外電子引力越大則粒子半徑越小。所以其粒子半徑大小是:鎂離子<鈉離子<氟離子<氧離子。
(1)共價半徑:兩原子之間(原子可以相同也可以不相同)以共價鍵結合時,兩核間距離的一半。實際上核間距離即是共價鍵的鍵長。
(2)金屬半徑:金屬晶體中相鄰兩金屬原子間距離的一半。
(3)範式半徑:靠范德華力相互吸引的相鄰不同分子中的兩個相同原子核間距離的一半。
原子半徑大小與以下三個方面有關
電子層數 核內質子數 電子數
(核內質子數=核電荷數)
1.電子層數越多 原子半徑就越大(適用於同主族)
2.核內質子多 那麼原子核質量就大 對電子的束縛能力就強 原子半徑反而越小
3.電子數越多 原子半徑越大
比較同一周期的原子半徑大小 就看核內質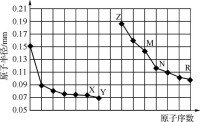 子數
子數

原子半徑
比較同一族元素就看電子層數
如果兩種元素的周期和族都不同 那麼主要考慮電子層數 與最外層電子數一般沒有關係
如果將原子假設成一個球體的話,標準原子的直徑大約為10的-10米。
2補充特別說明:指原子相互作用有效範圍的一半,亦即相鄰原子核間距的一半。則原子半徑約為10^(-10)m。
原子並沒有確切的大小,所謂的有效尺寸是指原子在化學運動中所表現出來的原子間距,即吸引力與排斥力的平衡距離。
根據相互作用力的不同,有以下幾種有效半徑:
范德華半徑、金屬半徑、離子半徑和共價半徑。
分子間的相互作用力(van der Waals forces)
主要有:荷電基團、偶極子、誘導偶極子之間的相互作用,氫鍵、疏水基團相互作用,堆疊作用以及非鍵電子排斥作用等。
取向力(orientation force)
固有偶極之間的電性引力
極性分子相互靠近時,因分子的固有偶極之間同極相斥異極相吸,使分子在空間按一定取向排列,使體系處於更穩定狀態。這種固有的偶極間的作用力稱為取向力。其實質是靜電力。
誘導力(induction force)
誘導偶極與固有偶極之間的電性引力
由於瞬時偶極的產生,引起的分子間的相互作用力,稱為色散力
總結:取向力,誘導力和色散力統稱為van der Waals力。在極性分子之間存在取向力、誘導力和色散力,在極性分子和非極性分子之間存在誘導力和色散力,在非極性分子與非極性分子之間存在色散力。
氫鍵(hydrogen bond)
X—H…Y用來表示氫鍵,其中X—Hσ鍵的電子云偏向高電負性的X原子,導致出現屏蔽小的帶正電性的氫原子核,它強烈地被另一個高電負性的Y原子所吸引。
氫鍵的一些特點:
1)方向性:由於H原子體積小,為了減少X和Y之間的斥力,它們盡量遠離,鍵角接近180°,這就是氫鍵的方向性
2)飽和性:又由於氫原子的體積小,它與較大的X、Y接觸后,另一個較大的原子就難於再向它靠近,所以氫鍵中氫的配位數一般為2,這就是氫鍵的飽和性。
分子間作用能E-r曲線會出現最低點。相應這最低點的距離即平衡距離。也就是說,當分子相互接近,到吸引和排斥達到平衡時,體系能量最低。此時分子間保持一定的接觸距離。相鄰分子相互接觸的原子間的距離即為該兩原子的范德華半徑和。范德華半徑比共價半徑大,變動範圍也大,即守恆性差。
把原子間的最近的接觸距離除以2,即得金屬原子半徑。
金屬原子半徑在周期表中的變化有一定的規律性
1.同一族元素原子半徑隨原子序數的增加而增加
2.同一周期的金屬元素的原子半徑,除個別例外,從左到右,先是逐漸減小,然後緩慢增加。
3.鑭系收縮效應
受到鑭收縮效應的影響,第二長周期比第一長周期同族元素的半徑大,但第三長周期與第二長周期的同族元素的半徑卻極相近,Zr和Hf、Nb和Ta、Mo和W的半徑極為近似,成為極難分離的元素,而Ru、Rh、Pd、Os、Ir、Pt 6個元素的原子半徑和化學性質相似,通稱鉑族元素。
金屬原子半徑和配位數有關,配位數高,半徑大
同種元素的兩個電子以共價鍵 連接時,它們核間距離的1/2稱為該原子的共價半徑(如H2、O2 )
(1)異核原子間鍵長的計算值常常比實驗測定值稍大。
共價鍵長的極性修正:Shomaker-Stevenson公式。
(2)同樣一種化學鍵對不同分子有它的特殊性,鍵長也各有差異。例如同是C-C鍵,由於雜化形式發生改變,鍵中s軌道的成分發生變化時,C—C鍵長也發生變化,
當有離域∏鍵或其他復鍵存在時,就不能再用共價單鍵半徑計算鍵長。反之,根據鍵長可以了解鍵的性質。
在離子型晶體中,相鄰離子的核間距等於兩個離子的半徑之和。
離子半徑的測定
Lande(朗德)在1920年,通過對比下表(表中括弧內的數字為後來較精確的測定值)中具有NaCl型結構的化合物的晶胞參數后,認為MgS和MgS、MgSe和MnSe的晶胞參數幾乎相等,意味著在晶體中負離子和負離子已相接觸。他利用簡單的幾何關係,推出S2-和Se2-的離子半徑。
Wasastjerna(瓦薩斯雅那)在1925年按照離子的摩爾折射度正比於其體積的方法.劃分離子的大小。獲得8個正離子和8個負離子半徑.括F-(133pm)和O2-(132 Pm)。
Goldscbmidt(哥希密持)在1927年,採用Wasastjerna的F-和O2-的離子半徑數據,根據實驗測定的離子晶體中離子間的接觸距離的數據,引出80多種離子的半徑(Goldscbmidt離子半徑),至今仍在通用。
1927年Pauling據5個晶體(NaF、KCl、RbBr、CsI和Li2O)的核間距離數據,用半經驗方法推出大量的離子半徑。因為離子的大小由它最外層電子的分佈所決定,而最外層電子的分佈與有效核電荷成反比。
Shanon等根據離子的配位數、配位多面體的幾何構型、離子的自旋情況等條件,按不同條件下的接觸距離推引離子半徑。一套以O2-半徑為140pm出發,另一套以O2-半徑為132pm出發,得兩套有效離子半徑。
1) 同一主族,相同電荷離子,半徑自上而下增大.
Li+
2) 同一周期元素核外電子數相同的正離子隨著正電荷數的增加離子離子半徑顯著下降
3) 同一元素核外各種價態的離子,電子數越多,離子半徑越大
4) 核外電子數相同的負離子對,隨著負電價增加,半徑略有增加,但增加值不大
5) 鑭系元素三價正離子的半徑,從La3+到Lu3+依次下降,此為鑭系收縮效應所引起
目錄
