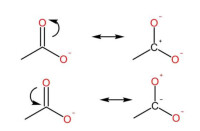
共軛酸鹼
布朗斯特和勞萊提出的質子理論
根據現代無機化學的定義,凡是能給出質子的物質都是酸,凡是能與質子結合的物質都是鹼,酸與鹼之間的這種關係稱為酸鹼共軛關係,相對應的酸鹼稱為共軛酸鹼。
布朗斯特(Brönsted)和勞萊(Lowry)在1923年提出的質子理論認為,凡是給出質子的任何物質(分子或離子)都是酸;凡是接受質子的任何物質都是鹼。簡單地說,酸是質子的給予體,而鹼是質子的接受體。酸和鹼之間的關係表示如下:
酸 =質子+ 鹼
同時還可以看出,酸和鹼是統一在對質子的關係上:酸放出質子后變成了鹼,而鹼接受質子后就變成了酸。為了表示它們之間的聯繫,常把酸鹼之間的這種關係叫做共軛酸鹼。酸放出質子后形成的鹼,叫做該酸的共軛鹼;鹼接受質子后形成的酸,叫做該鹼的共軛酸。我們把相差一個質子的對應酸鹼,叫做共軛酸鹼。根據酸鹼的質子理論,酸或鹼可以是中性分子,也可以是陽離子或陰離子。既有酸的性質又有鹼的性質的物質稱為兩性物質,同理,具有酸的性質又有鹼的性質的溶劑為兩性溶劑。酸或鹼的失去質子或得到質子總是在某種溶劑中進行的,而兩性溶劑分子之間本身就能發生質子的轉移反應,即質子自遞作用。
按酸鹼質子論,酸和鹼並不是彼此孤立的,而統一在對質子的關係上,這種關係可以表示為:
酸=鹼 + 質子
即,酸給出質子后就成為鹼,鹼接受質子后就變成酸。滿足上述關係的一對酸和鹼稱為共軛酸鹼(conjugate acid-base pair)。
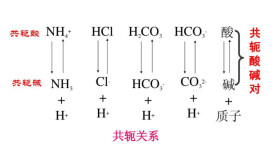
例如HCN-CN就構成了一個共軛酸鹼對。HCN是CN的共軛酸(conjugate acid),反過來,CN是HCN的共軛鹼(conjugate base)。
又如:HClH+ HCl
HCOH+ HCO
NHH+ NH
HPOH+ HPO
[Al(HO)]H+ [Al(HO)OH]
根據酸鹼的質子理論,容易放出質子的物質是強酸,而該物質放出質子后就不容易形成鹼,同質子結合能力弱,因而是弱的鹼。換言之,酸越強,它的共軛鹼就越弱;反之,鹼越強,它的共軛酸就越弱。
根據酸鹼質子理論,酸鹼在溶液中所表現出來的強度,不僅與酸鹼的本性有關,也與溶劑的本性有關。我們所能測定的是酸鹼在一定溶劑中表現出來的相對強度。同一種酸或鹼,如果溶於不同的溶劑,它們所表現的相對強度就不同。例如HAc在水中表現為弱酸,但在液氨中表現為強酸,這是因為液氨奪取質子的能力(即鹼性)比水要強得多。這種現象進一步說明了酸鹼強度的相對性。
酸鹼質子理論擴大了酸鹼的含義及酸鹼反應的範圍,擺脫了酸鹼必須發生在水中的局限性,解決了非水溶液或氣體間的酸鹼反應,並把在水溶液中進行的解離、中和、水解等類反應概況為一類反應,即質子傳遞式的酸鹼反應。但是,質子理論只限於質子的放出和接受,所以必須含有氫,不能解釋不含氫的一類化合物的反應。它包含了所有鹼性的物質,是仍限制在含氫基礎上。
與電離理論最大的不同在於,質子理論裡面只有酸鹼的概念,而沒有鹽的概念。因此,在緩衝溶液中,緩衝對即為一對共軛酸鹼對。實際上應用共軛酸鹼對的概念,緩衝溶液可以只分成兩類,即弱酸及其共軛鹼和弱鹼及其共軛酸兩類。此外,在高濃度的強酸強鹼溶液中,由於H或OH的濃度本來就很高,外加少量酸或鹼不會對溶液的酸度產生太大的影響,在這種情況下,強酸強鹼也是緩衝溶液,它們主要是高酸度(pH<2)和高鹼度(pH>12)時的緩衝溶液。
以HB—B緩衝溶液體系為例,HB和B的起始濃度很大,體系中存在共軛酸HB和它的共軛鹼。根據酸鹼反應的原則,不難知道,如果向此溶液中加入少量強酸時,溶液中的共軛鹼可以接受H,生成HB,從而抵抗H對pH的影響。如果向此溶液中加入少量強鹼時,溶液中的共軛酸HB可以接受羥基,生成B,從而抵抗OH對pH的影響。因為共軛酸鹼對的存在,所以可以抵抗少量外加酸鹼,從而保持緩衝溶液的pH值基本不變。
實際工作中需要製備某一pH值的緩衝溶液時,可按下列步驟進行:
按照電離理論,選擇一種緩衝對,使其中弱酸(或弱鹼)的pKa(或pKb)與所需要的pH(或pOH)相等或相近,如pKa或(pKb)與所需要的pH(或pOH)值不完全相等時,則按所要求的pH(或pOH)值,利用緩衝方程式,計算出所需的弱酸(或弱鹼)和鹽的濃度比。按照質子理論,僅僅將“鹽”換成“共軛鹼”(或“共軛酸”)而已。