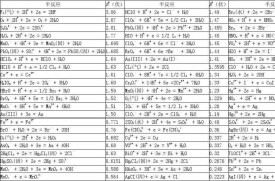
標準電極電位
以氫原子作為參比電極的電勢
標準電極電位,即標準電極電勢,指的是當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位。非標態下的標準電極電位可由能斯特方程導出。
金屬浸在只含有該金屬鹽的電解溶液中,達到平衡時所具有的電極電位,叫做該金屬的平衡電極電位。當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位,叫做標準電極電位。
什麼叫標準電極電位
電極電位是表示某種離子或原子獲得電子而被還原的趨勢。如將某一金屬放入它的溶液中(規定溶液中金屬離子的濃度為1 M),在25℃時,金屬電極與標準氫電極(電極電位指定為零)之間的電位差,叫做該金屬的標準電極電位。
非標態下的標準電極電位可由能斯特方程導出。
為了能正確使用標準電極電位表(課本或化學手冊上均有較詳細的表),現將有關的一些問題敘述如下:
(1)在電極反應中,M叫做物質的還原態。叫做物質的氧化態,物質的還原態和氧化態構成氧化還原電對。電對也常用符號來表示,例如是一個電對,也是一個電對等。
(2)在表中所列的標準電極電位的正、負數值,因電極反應進行的方向而改變。例如,當電極反應按,或者按的方式進行時,電對()的標準電極電位符號是相反的。
(3)在表中,物質的還原態的還原能力自下而上依次增強;物質的氧化態的氧化能力自上而下依次增強。具體地說,電對的電極電位數值越小,在表中的位置越高,物質的還原態的還原能力越強,電對的電極電位數值越大,在表中的位置越低,物質的氧化態的氧化能力越強。例如電對的標準電極電位的數值為-0.76伏較Cu數值+0.34伏為小,所以Zn原子較Cu原子容易失去電子,即Zn是較強的還原劑。
(4)物質的還原態的還原能力越強,其對應的氧化態的氧化能力就越弱,標準電極電位越小;物質氧化態的氧化能力越強,其對應的還原態的還原能力就越弱,標準電極電位越大。例如表7—2中K是最強的還原劑,其對應的K+離子則是最弱的氧化劑,F2是最強的氧化劑,其對應的F則是最弱的還原劑。
(5)只有電極電位數值較小的物質的還原態與電極電位數值較大的物質的氧化態之間才能發生氧化還原反應,兩者電極電位的差別越大,反應就進行得越完全。