電子構型
電子構型
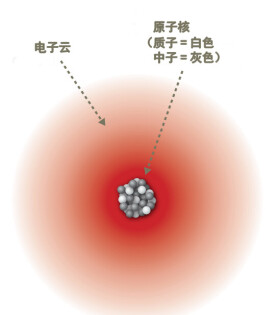
電子構型,又稱電子組態。是原子、離子或分子的電子狀態的一種標誌。按照量子力學的軌道近似法,原子、離子或分子中的每一個電子被認為各處於某自旋和軌道的狀態。能量高的離核較遠,能量低的離核較近。通常把電子在離核遠近不同的區域內運動稱為電子的分層排布。體系中全體電子所處的自旋和軌道的總體,構成了整個體系的電子構型。
-內部模型圖
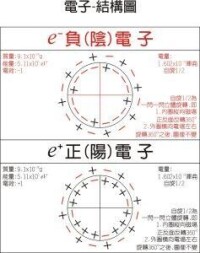
構型量軌量角量。整。軌稱屬殼層。距離核近殼層,殼層依編號:、、、、、、、…,符號、、、、、、、…示。越,離核愈近,殼層量愈低。屬量,軌角動量可以是0、、、…、,分別用角量子數l等於0、1、2、…、(n-1)表示,記為s、p、d、f、g、…。例如同屬於n=3,l=0、1和2的軌道,分別稱為3s、3p和3d軌道。l愈小表示電子軌道運動的能量愈小。角量子數為l的軌道內含有2(2l+1)個軌道。所以s、p、d和f軌道內分別含有2、6、10和14個軌道。由此推算:主量子數為n的殼層中軌道的總數為:
即=、、、…殼層含、、、、…軌。,系狀態量集合(、、…、)示,集合稱構型。
軌量依:

電子構型
ls<2s<2p<3s<3p<4s<3d<4p<5s<4d
<5p<6s<4f<5d<6p<7s<5f<6d…
(括弧指可能的電子層排布)
1.H1s1
2.He1s2
3.Li2s1
4.Be2s2
5.B2s22p1
6.C2s22p2
7.N2s22p3
8.O2s22p4
9.F2s22p5
10.Ne2s22p6
11.Na3s1
12.Mg3s2
13.Al3s23p1
14.Si3s23p2
15.P3s23p3
16.S3s23p4
17.Cl3s23p5
18.Ar3s23p6
19.K4s1
20.Ca4s2
21.Sc3d14s2
22.Ti3d24s2
23.V3d34s2
24.Cr3d54s1
25.Mn3d54s2
26.Fe3d64s2
27.Co3d74s2
28.Ni3d84s2
29.Cu3d104s1
30.Zn3d104s2
31.Ga4s24p1
32.Ge4s24p2
33.As4s24p3
34.Se4s24p4
35.Br4s24p5
36.Kr4s24p6
37.Rb5s1
38.Sr5s2
39.Y4d15s2
40.Zr4d25s2
41.Nb4d45s1
42.Mo4d55s1
43.Tc4d55s2
44.Ru4d75s1
45.Rh4d85s1
46.Pd4d10
47.Ag4d105s1
48.Cd4d105s2
49.In5s25p1
50.Sn5s25p2
51.Sb5s25p3
52.Te5s25p4
53.I5s25p5
54.Xe5s25p6
55.Cs6s1
56.Ba6s2
57.La5d16s2
58.Ce4f15d16s2
59.Pr4f36s2
60.Nd4f46s2
61.Pm4f56s2
62.Sm4f66s2
63.Eu4f76s2
64.Gd4f75d16s2
65.Tb4f96s2
66.Dy4f106s2
67.Ho4f116s2
68.Er4f126s2
69.Tm4f136s2
70.Yb4f146s2
71.Lu4f145d16s2
72.Hf5d26s2
73.Ta5d36s2
74.W5d46s2
75.Re5d56s2
76.Os5d66s2
77.Ir5d76s2
78.Pt5d96s1
79.Au5d106s1
80.Hg5d106s2
81.Tl6s26p1
82.Pb6s26p2
83.Bi6s26p3
84.Po6s26p4
85.At6s26p5
86.Rn6s26p6
87.Fr7s1
88.Ra7s2
89.Ac6d17s2
90.Th6d27s2
91.Pa5f26d17s2
92.U5f36d17s2
93.Np5f46d17s2
94.Pu5f67s2
95.Am5f77s2
96.Cm5f76d17s2
97.Bk5f97s2
98.Cf5f107s2
99.Es5f117s2
100.Fm5f127s2
101.Md(5f137s2)
102.No(7s2)
103.Lr(6d17s2)
104.Rf(6d27s2)
105.Db(6d37s2)
106.Sg6d47s2
107.Bh6d57s2
108.Hs6d67s2
109.Mt6d77s2
110.Ds6d97s1
111.Rg7s1
112.Cn7s2
113.Uut7p1
114.Uuq7p2
115.Uup7p3
116.Uuh7p4
117.Uus7p5
118.Uuo7p6
119.Uue7p7
新華社倫敦09年8月2日電(記者黃堃)英國研究人員最近通過實驗證實了電子可分裂為自旋子和空穴子的理論假設,這一進展將有助於研製下一代量子計算機。英國劍橋大學日前發布新聞公報說,該校研究人員和伯明翰大學的同行合作完成了這項研究。公報稱,電子通常被認為不可分。但1981年有物理學家提出,在某些特殊條件下電子可分裂為帶磁的自旋子和帶電的空穴子。劍橋大學研究人員將極細的“量子金屬絲”置於一塊金屬平板上方,控制其間距離為約30個原子寬度,並將它們置於約零下273攝氏度的超低溫環境下,然後改變外加磁場,發現金屬板上的電子在通過量子隧穿效應跳躍到金屬絲上時分裂成了自旋子和空穴子。研究人員說,人們對電子性質的研究曾掀起了半導體革命,使計算機產業飛速發展,現在又出現了實際研究自旋子和空穴子性質的機會,這可能會促進下一代量子計算機的發展,帶來新一輪的計算機革命。
100多年前,當美國物理學家RobertMillikan首次通過實驗測出電子所帶的電荷為1.602E-19C后,這一電荷
值變被廣泛看作為電荷基本單元。然而如果按照經典理論,將電子看作“整體”或者“基本”粒子,將對電子在某些物理情境下的行為感到極端困惑,比如當電子被置入強磁場后出現的非整量子霍爾效應。為了解決這一難題,1980年,美國物理學家RobertLaughlin提出一個新的理論解決這一迷團,該理論同時也十分簡潔地詮釋了電子之間複雜的相互作用。然而接受這一理論確是要讓物理學界付出“代價”的:由該理論衍生出的奇異推論展示,電流實際上是由1/3電子電荷組成的。
電子是物質的相對基本形式,同質子相比是一種相對單純的存在,同質子不在一個級別,是質子的下一級別。通過撞擊,電子可以產生任何形式的基本粒子。
在一項新的實驗中,Weizmann機構的科學家設計出精妙的方法去檢驗這一非整電子電荷是否存在。該實驗將能很好地檢測出所謂的“撞擊背景雜訊”,這是分數電荷存在的直接證據。科學家將一個有電流通過的半導體浸入高強磁場,非整量子霍爾效應隨之被檢測出來,他們又使用一系列精密的儀器排除外界雜訊的干擾,該雜訊再被放大並分析,結果證實了所謂的“撞擊背景雜訊”的確來源於電子,因而也證實了電流的確是由1/3電子電荷組成。由此他們得出電子並非自然界基本的粒子,而是更“基本”更“簡單”且無法再被分割的亞原子粒子組成。
亨利·莫塞萊和巴克拉的X射線吸收研究首次於實驗中發現電子層。巴克拉把它們稱為K、L和、M(以英文子母排列)等電子層(最初K和L電子層名為B和A,改為K和L的原因是預留空位給未發現的電子層)。這些字母後來被n值1.2.3等取代。它們被用於分光鏡的西格班記號法。
電子層的名字起源於波耳模型中,電子被認為一組一組地圍繞著核心以特定的距離旋轉,所以軌跡就形成了一個殼。
基本定義
電子構型是指:電子依照能量高低的能級進行排列,其一般順序為:ls,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d
電子排布式定義
電子排布式則是指:電子依照能層的順序進行排列,其一般順序為:
1s,2s,2p,3s,3p,3d,4s,4p,4d,4f...
不相容原理
每個軌道上最多容納一個自旋平行的電子。根據能量最低原理,電子傾向於先佔有能量最低的軌道。又根據洪德規則,能量相等的軌道上若自旋平行的電子數最多時整個體系的能量最低。根據這三個原理向軌道填入電子,得到的原子總能量最低,即基態原子。例如鋁原子核外,當其1s、2s、2p、3s和3p軌道上分別填入2個、2個、6個、2個和1個電子時,為鋁原子基態,因此鋁原子基態的電子構型為1s2s2p3s3p。實際上除最外層(n=3的軌道)之外,它完全與元素周期表上前一周期末的惰性氣體氖的電子構型1s2s2p相同,所以鋁原子基態的電子構型又可簡單記為【Ne】3s3p。正三價鋁離子(Al)的電子構型與氖原子相同。
分子體系的電子狀態也可以用全體電子所處的單電子軌道的總體來表示。以異核雙原子分子NO為例:分子軌道按照它在分子軸向上沒有節面、有一個節面或有二個節面而分別稱為σ、π或δ分子軌道。各類分子軌道內,按能量次序由低向高排列編號(如1σ、2σ、3σ、4σ…,和1π、2π、3π…)。每個σ分子軌道內含有2個電子,π分子軌道內有4個電子……再按照上述的泡利不相容原理、能量最低原理和洪特原則,將原先氮原子的7個電子和氧原子的8個電子(共15電子)填入分子軌道,並且按分子軌道的能量次序由低向高寫出:
(1σ)2(2σ)2(3σ)2(4σ)2(1π)4(5σ)2(2π)1
配合物的電子構型指中心原子的價電子數。
例:IrCl[P(CH3)3]3中的Ir是16電子的構型,而IrCl3[P(CH3)3]3中的Ir是18電子的構型。
寫為KK(3σ)2(4σ)2(1π)4(5σ)2(2π)1。

電子構型