內質網應激
內質網應激
內質網應激,是指在缺氧,氧化應激,異常糖基化反應以及鈣離子穩態失衡情況下,內質網未摺疊的蛋白質會明顯增多,當超出內質網處理能力時,細胞會激活一些相關信號級聯反應,來應對條件的變化和恢復內質網良好的蛋白質摺疊環境。
內質網內環境的穩定是實現內質網功能的基本條件,因此內質網具有極強的內穩態體系. 但仍然有很多因素可導致內質網功能的內穩態失衡,形成內質網應激。例如缺血再灌注損傷、氧化應激、同型半胱氨酸 等化學物質處理、細胞內蛋白質合成過快以至於超過蛋白摺疊能力、內質網鈣代謝紊亂、卵磷脂合成障礙等多種物理、化學或遺傳因素等均可引發內質網應激。
內質網是真核細胞中蛋白質合成、摺疊與分泌的重要細胞器。細胞進化出一套完整的機制來監督和幫助內質網內蛋白質的摺疊與修飾。而當錯誤摺疊的蛋白質累積時,細胞通過一系列信號轉導途徑,對其進行應答,包括增強蛋白質摺疊能力、停滯大多數蛋白質的翻譯、加速蛋白質的降解等。如果內質網功能紊亂持續,細胞將最終啟動caspase12依賴的細胞凋亡程序。這些反應被統稱為未摺疊蛋白質應答(unfolded protein response,UPR)
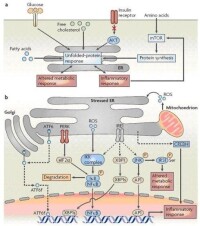
內質網應激
大量研究表明:發生ERS的細胞能調節ERS相關性促凋亡分子如CHOP和caspase-12等和促存活分子如GADD34和BiP等的表達/活化,最終決定細胞是適應還是凋亡。細胞ER因素ER含有大量的伴侶蛋白、糖基化酶以及氧化還原酶為新生膚鏈的摺疊提供了優化的環境,同時ER質量控制系統(ERqualityeontrolsystem)能通. 過ER相關降解作用(ER assoeiated degradation ERAD)降解非正確摺疊的中間產物,凡影晌ER功能的因素都能夠引起ERstress,包括有下列各種因素:
1.細胞營養物質缺乏包括葡萄糖飢餓和氨基酸飢餓,蛋白質及核昔酸的生物合成均需要必要的營養物質,所以葡萄糖飢餓和氨基酸飢餓代表一種代謝壓力。
2.影響蛋白質翻譯后修飾的因素,如還原物質二琉基蘇糖醇(DTT)、β琉基乙醇(β-ME)、同型半朧氨酸(homoeystine);糖基化抑製劑衣黴素(tunieamyein)、葡萄糖胺(glueosamine)、2-脫氧葡萄糖(2-deoxyglueose)等。3.影響ER鈣離子平衡的藥物,如ER Ca2+酶抑製劑Thapsigagrin,鈣離子載體A23187,鈣離子鰲合劑EGTA,抗生素lonomycin等。
4.突變基因表達的結構異常蛋白在ER堆積。5.其它一些有害因素如細胞病毒感染等。信號通路Irel通路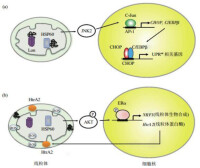 哺乳動物細胞有2個Irelp同源物,Irelα和Irelβ,具有和Irelp相同的3個功能域, Irelα在各種細胞普遍存在,而Irelβ主要存在於消化道上皮細胞七。類似於酵母的Irelp, Irelα活化后,N端和BIP分離,c端具有核酸內切酶活性,能特異性地剪接轉錄因子xBPI的mRNA去除26個bp組成的片段,XBPI和HaCI的mRNA不具有同源性,但剪接機制類似。剪接后的XBPI mRNA具有活性,翻譯產物與剪接前相比C端由於讀碼框移而改變。類似酵母,哺乳動物細胞的UPR靶基因含有保守的順式作用元件ERSE,是由19個bp組成:ccAAT-Ng-ccAcG,當其ccAcG結合活化的xBPI或ATF6,同時ccAAT結合非特異性轉錄因子NF-Y,才能上調靶基因表達。
哺乳動物細胞有2個Irelp同源物,Irelα和Irelβ,具有和Irelp相同的3個功能域, Irelα在各種細胞普遍存在,而Irelβ主要存在於消化道上皮細胞七。類似於酵母的Irelp, Irelα活化后,N端和BIP分離,c端具有核酸內切酶活性,能特異性地剪接轉錄因子xBPI的mRNA去除26個bp組成的片段,XBPI和HaCI的mRNA不具有同源性,但剪接機制類似。剪接后的XBPI mRNA具有活性,翻譯產物與剪接前相比C端由於讀碼框移而改變。類似酵母,哺乳動物細胞的UPR靶基因含有保守的順式作用元件ERSE,是由19個bp組成:ccAAT-Ng-ccAcG,當其ccAcG結合活化的xBPI或ATF6,同時ccAAT結合非特異性轉錄因子NF-Y,才能上調靶基因表達。

非摺疊蛋白反應主要的三條通路
有研究表明除了ERSE外,還存在功能類似的ERSEll(ATrGG-N-eCACG)。xBPI基因本身也含有ERSE,故剪接后的XBP-1蛋白除了能促進VPR靶基因的表達外,還能促進自身的表達。PERK(PEK)通路PERK屬於eIF2α蛋白激酶家族成員,和lrelα類似,是位於ER的I型膜蛋白,N端感受ERstress信號,存在非配體依賴性的二聚化結構域,非ERstress時二聚化位點被BIP遮蓋,C端有絲/蘇氨酸蛋白激酶功能域,但無核酸內切酶活性,PERK活化后能夠特異性地磷酸化eIFZα的51位的絲氨酸,下調胞內蛋白合成的整體水平。當病毒感染或ER內鈣離子耗竭引起ERStress時,存在於胞漿中的與PERK同源的蛋白激酶PKR也參與eIF2α的磷酸化。
有研究表明,PERK活化后能特異性地抑制細胞周期素Dl的翻譯表達,導致G.期的停頓。PERK磷酸化el兄。后抑制胞內大部分蛋白的翻譯生成,同時也誘導三分之一的UPR基因的轉錄,其中包括XBPI基因,但機制並不清楚。ATF6通路ATF6是位於ER的n型膜蛋白,哺乳動物細胞具有兩種ATF6亞型ATF6α(90ku)和ATF6β(110ku),二者結構相似。N端是含有bZIP的轉錄激活功能域,C端位於ER腔內,具有多個BIP結合位點和兩個高爾基體定位信號。非ERsrress時,ATF6和BIP形成穩定的複合物,通過BIP對GLS的抑制作用而停留在ER上。ATF6α和ATF6β在UΒR過程中通過相同的機制活化,ER腔內未摺疊蛋白堆積信息能夠使BIP和ATF6分離,BIP對GLs抑制作用的解除導致ATF6轉移到高爾基體,由高爾基體蛋白酶S1P及S2P對其跨膜片段進行切割,產生遊離的50kuN端片段,該過程類似於固醇反應元件結合蛋白(SRE-BΒ)的切割活化。活化的ATF6N端切割段可轉移到核內促進含ERSE的轉錄因子(如XBPI)及UPR靶分子(如BIP)等基因轉錄,ATF6α和XBP1在功能上有所重疊,而ATF6日在UPR過程中並不起重要作用。
有研究發現,除了ERsE外還存在有特異的ATF6結合位點(ATF6site):(G)(G)TGΑCGTG(G/Α),但ATF6Site在UPR過程中的作用並不很清楚,有趣的是ATF6site介導的基因轉錄可能完全依賴於Irel剪接系統,XBPI比ATF6有更高的ATF6Site親和力,ATF6在NF-Y存在時對ERSE有更高的親和力。