蛋白質摺疊
蛋白質摺疊
蛋白質摺疊密碼又稱第二遺傳密碼,即指氨基酸順序與蛋白質三維結構之間存在的對應關係。
蛋白質摺疊
蛋質摺疊研究,較狹義義研究蛋質維空構形規律、穩系。概念熱力學的問題和動力學的問題;蛋白質在體外摺疊和在細胞內摺疊的問題;有理論研究和實驗研究的問題。這裡最根本的科學問題就是多肽鏈的一級結構到底如何決定它的空間結構?既然前者決定後者,一級結構和空間結構之間肯定存在某種確定的關係,這是否也像核苷酸通過“三聯密碼”決定氨基酸順序那樣有一套密碼呢?有人把這設想的一級結構決定空間結構的密碼叫作“第二遺傳密碼”。
蛋質複雜化合,舊稱“朊(ǎ)”。氨基酸組蛋質基單,氨基酸脫縮合連肽鏈。蛋白質是由一條或多條多肽鏈組成的生物大分子,每一條多肽鏈有二十至數百個氨基酸殘基(-R)不等;各種氨基酸殘基按一定的順序排列。蛋白質的氨基酸序列是由對應基因所編碼。除了遺傳密碼所編碼的20種基本氨基酸,在蛋白質中,某些氨基酸殘基還可以被翻譯后修飾而發生化學結構的變化,從而對蛋白質進行激活或調控。多個蛋白質可以一起,往往是通過結合在一起形成穩定的蛋白質複合物,摺疊或螺旋構成一定的空間結構,從而發揮某一特定功能。合成多肽的細胞器是細胞質中糙面型內質網上的核糖體。蛋白質的不同在於其氨基酸的種類,數目,排列順序和肽鏈空間結構的不同。
蛋白質分子的結構決定了它的功能。
一級結構:蛋白質多肽鏈中氨基酸的排列順序,以及二硫鍵的位置。
二級結構:蛋白質分子局區域內,多肽鏈沿一定方向盤繞和摺疊的方式。
三級結構:蛋白質的二級結構基礎上藉助各種次級鍵捲曲摺疊成特定的球狀分子結構的空間構象。四級結構:多亞基蛋白質分子中各個具有三級結構的多肽鏈,以適當的方式聚合所形成的蛋白質的三維結構。
連接方法:用約20種氨基酸作原料,在細胞質中的核糖體上,將氨基酸分子互相連接成肽鏈。一個氨基酸分子的氨基,脫去一分子水而連接起來,這種結合方式叫做脫水縮合。通過縮合反應,在羧基和氨基之間形成的連接兩個氨基酸分子的那個鍵叫做肽鍵。由肽鍵連接形成的化合物稱為肽。
蛋白質摺疊
蛋白質摺疊
根據克里斯琴·B·安芬森(1972年的諾貝爾化學獎得主)的研究,蛋白質可由加熱或置於某些化學環境而變性,三級結構解體;而當環境回復到原本的狀態時,蛋白質可於不到一秒的時間摺疊至原先的立體結構,不論試驗幾次,蛋白質都僅此一種立體結構,於是Anfinsen提出一個結論:蛋白質分子的一級結構決定其立體結構。
安芬森的研究結果非常重要,因為蛋白質的功能取決於其立體結構,而目前根據已知某基因序列可翻譯獲得對應蛋白質的氨基酸序列,既蛋白質的一級結構;如果從蛋白質的一級結構就能知道立體結構,那麼即可直接從基因推測其編碼蛋白質所對應的生物學功能。雖然蛋白質可在短時間中從一級結構摺疊至立體結構,研究者卻無法在短時間中從氨基酸序列計算出蛋白質結構,甚至無法得到準確的三維結構。因此,研究蛋白質摺疊的過程,可以說是破譯“第二遺傳密碼”——摺疊密碼(foldingcode)的過程。
目前蛋白質的再摺疊依然遵從先使用胍或脲變性,然後逐漸降低降低胍或者脲的濃度,也就是逐漸降低對蛋白質天然“回縮”能力的干擾。使其自然回到天然的最低能量狀態。只是這個過程無法很好的控制肽鏈與肽鏈之間和肽鏈內部形成錯誤摺疊的干擾。
在生物體內,生物信息的流動可以分為兩個部分:第一部分是存儲於DNA序列中的遺傳信息通過轉錄和翻譯傳入蛋白質的一級序列中,這是一維信息之間的傳遞,三聯子密碼介導了這一傳遞過程;第二部分是肽鏈經過疏水塌縮、空間盤曲、側鏈聚集等摺疊過程形成蛋白質的天然構象,同時獲得生物活性,從而將生命信息表達出來;而蛋白質作為生命信息的表達載體,它摺疊所形成的特定空間結構是其具有生物學功能的基礎,也就是說,這個一維信息向三維信息的轉化過程是表現生命活力所必需的。
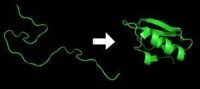
結構決定功能,僅僅知道基因組序列並不能使我們充分了解蛋白質的功能,更無法知道它是如何工作的。蛋白質可憑藉相互作用在細胞環境(特定的酸鹼度、溫度等)下自己組裝自己,這種自我組裝的過程被稱為蛋白質摺疊。
蛋白質摺疊問題被列為“21世紀的生物物理學”的重要課題,它是分子生物學中心法則尚未解決的一個重大生物學問題。從一級序列預測蛋白質分子的三級結構並進一步預測其功能,是極富挑戰性的工作。
自從20世紀60年代,Anfinsen基於還原變性的牛胰RNase在不需其他任何物質幫助下,僅通過去除變性劑和還原劑就使其恢復天然結構的實驗結果,提出了“多肽鏈的氨基酸序列包含了形成其熱力學上穩定的天然構象所必需的全部信息”的“自組裝學說”以來,隨著對蛋白質摺疊研究的廣泛開展,人們對蛋白質摺疊理論有了進一步的補充和擴展。Anfinsen的“自組裝熱力學假說”得到了許多體外實驗的證明,的確有許多蛋白在體外可進行可逆的變性和復性,尤其是一些小分子量的蛋白,但是並非所有的蛋白都如此。而且由於特殊的環境因素,體內蛋白質的摺疊遠非如此。
體內蛋白質的摺疊往往需要有其他輔助因子的參與,並伴隨有ATP的水解。因此,Ellis於1987年提出了蛋白質摺疊的“輔助性組裝學說”。這表明蛋白質的摺疊不僅僅是一個熱力學的過程,顯然也受到動力學的控制。有的學者基於有些相似氨基酸序列的蛋白質具有不同的摺疊結構,而另外一些不同氨基酸序列的蛋白質在結構上卻相似的現象,提出了mRNA二級結構可能作為一種遺傳密碼從而影響蛋白質結構的假說。但目前為止,該假說尚沒有任何實驗證據,只有一些純數學論證。那麼,蛋白質的氨基酸序列究竟是如何確定其空間構象的呢?圍繞這一問題科研人員已進行了大量出色的工作,但迄今為止我們對蛋白質的摺疊機制的認識仍是不完整的,甚至有些方面還存在著錯誤的觀點。

蛋白質摺疊
研究蛋白質的摺疊,是生命科學領域的前沿課題之一。蛋白質是一種生物大分子,基本上是由20種氨基酸以肽鍵連接成肽鏈。肽鏈在空間捲曲摺疊成為特定的三維空間結構,包括二級結構和三級結構二個主要層次。有的蛋白質由多條肽鏈組成,每條肽鏈稱為亞基,亞基之間又有特定的空間關係,稱為蛋白質的四級結構。所以蛋白質分子有非常特定的複雜的空間結構。
通過“蛋白質結構預測”破譯“第二遺傳密碼”,是蛋白質研究最後幾個尚未揭示的奧秘之一。天津大學和中國科學院生物物理所的科學家已經做出了優秀的研究成果。他們預測,蛋白質的種類雖然成千上萬,但它們的摺疊類型卻只有有限的650種左右。我國科學家在分子伴侶和摺疊酶方面有特色的研究成果,也已經贏得了國際同行的注意。
外界環境的變化可以導致蛋白質空間結構的破壞和生物活性的喪失,但卻並不破壞它的一級結構(氨基酸序列),這稱為蛋白質的變性。變性的蛋白質往往成為一條伸展的肽鏈,在一定的條件下可以重新摺疊成原有的空間結構並恢復原有的活性。對蛋白質變性作用的認識是我國科學家吳憲在三十年代首先提出的。
DNA)分子的三維空間結構,闡明了生物遺傳的分子基礎,揭示了這個最主要的生命活動的本質,從而開創了在分子水平上認識生命現象的新學科———分子生物學。分子生物學的出現是經典生物學轉變成近代生物學的里程碑。
儘管自然界的生物物種千千萬萬,生命現象繁雜紛飛,在分子水平研究生命,使我們認識到各種生命現象的基本原理卻是高度一致的!從最簡單的單細胞生物到最高等的人類,它們最基本最重要的組成物質都是蛋白質和核酸。核酸是生物體遺傳信息的攜帶者,所有生物體能世代相傳,就是依靠核酸分子可以精確複製的性質。蛋白質則是生命活動的主要承擔者。所有的生命活動,呼吸、運動、消化……甚至感知、思維和學習,無一例外是依靠蛋白質來完成的。
蛋白質是一種生物大分子,基本上是由20種氨基酸以肽鍵連接成肽鏈。肽鍵連接成肽鏈稱為蛋白質的一級結構。不同蛋白質其肽鏈的長度不同,肽鏈中不同氨基酸的組成和排列順序也各不相同。肽鏈在空間捲曲摺疊成為特定的三維空間結構,包括二級結構和三級結構二個主要層次。有的蛋白質由多條肽鏈組成,每條肽鏈稱為亞基,亞基之間又有特定的空間關係,稱為蛋白質的四級結構。所以蛋白質分子有非常特定的複雜的空間結構。每一種蛋白質分子都有自己特有的氨基酸的組成和排列順序,由這種氨基酸排列順序決定它的特定的空間結構,這就是榮獲諾貝爾獎的著名的Anfinsen原理。蛋白質分子只有處於它自己特定的三維空間結構情況下,才能獲得它特定的生物活性;三維空間結構稍有破壞,就很可能會導致蛋白質生物活性的降低甚至喪失。
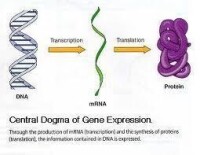
二十世紀生物學領域最重要的成就之一,是繼DNA雙螺旋結構的發現總結出分子生物學的中心法則,揭示生命遺傳信息傳遞的方向和途徑。近半個世紀以來對闡明中心法則有關問題有傑出貢獻而獲得諾貝爾獎的學者先後多達34位。分子生物學的中心法則簡單表達如下:
分子生物學的中心法則中,DNA和核糖核酸(RNA)的複製、DNA轉錄成RNA、RNA逆轉錄成DNA以及以信使RNA為模板翻譯成多肽鏈的過程和機制基本上已經闡明。但從多肽鏈摺疊成蛋白質的過程,即所謂“新生肽的摺疊”問題,是中心法則至今留下的空白,又是從“遺傳信息”到“生物功能”的關鍵環節,有待我們在21世紀去解決。
蛋白質摺疊與“摺疊病”
大家都知道的瘋牛病,它是由一種稱為Prion的蛋白質的感染引起的,這種蛋白質也可以感染人而引起神經系統疾病。在正常機體中,Prion是正常神經活動所需要的蛋白質,而致病Prion與正常Prion的一級結構完全相同,只是空間結構不同。這一疾病的研究涉及到許多生物學的基本問題。一級結構完全相同的蛋白質為什麼會有不同的空間結構,這與Anfinsen原理是否矛盾?顯然這裡有蛋白質的能量和穩定性問題。
從來認為蛋白結構的變化來自於序列的變化,而序列的變化來自於基因的變化,生命信息從核酸傳遞到蛋白。而致病Prion的信息已被諾貝爾獎獲得者普魯辛納證明不是來自基因的變化,致病蛋白Prion導致正常蛋白Prion轉變為致病的摺疊狀態是通過蛋白分子間的作用而感染!這種相互作用的本質和機制是什麼?僅僅改變了摺疊狀態的分子又如何導致嚴重的疾病?這些問題都不能用傳統的概念給予滿意的解釋,因此在科學界引起激烈的爭論,有關研究的強度和競爭性也隨之大大增強。
由於蛋白質摺疊異常而造成分子聚集甚至沉澱或不能正常轉運到位所引起的疾病還有老年性痴呆症、囊性纖維病變、家族性高膽固醇症、家族性澱粉樣蛋白症、某些腫瘤、白內障等等。由於分子伴侶在蛋白質摺疊中至關重要的作用,分子伴侶本身的突變顯然會引起蛋白質摺疊異常而引起摺疊病。隨著蛋白質摺疊研究的深入,人們會發現更多疾病的真正病因和更針對性的治療方法,設計更有效的藥物。現在發現有些小分子可以穿越細胞作為配體與突變蛋白結合,從而使原已失去作戰能力的突變蛋白逃逸“蛋白質質量控制系統”而“帶傷作戰”。這種小分子被稱為“藥物分子伴侶”,有希望成為治療“摺疊病”的新葯。
新生肽的摺疊問題或蛋白質摺疊問題不僅具有重大的科學意義,除了上面提到的在醫學上的應用價值外,在生物工程上具有極大的應用價值。基因工程和蛋白工程已經逐漸發展成為產值以數十億美元計的大產業,進入21世紀后,還將會有更大的發展。但是當前經常遇到的困難,是在簡單的微生物細胞內引入異體DNA后所合成的多肽鏈往往不能正確摺疊成為有生物活性的蛋白質而形成不溶解的包含體或被降解。這一“瓶頸”問題的徹底解決有待於對新生肽鏈摺疊更多的認識。
如果說“三聯密碼”已被破譯而實際上已成為明碼,那麼破譯“第二遺傳密碼”正是“蛋白質結構預測”從理論上最直接地去解決蛋白質的摺疊問題,這是蛋白質研究最後幾個尚未揭示的奧秘之一。“蛋白質結構預測”屬於理論方面的熱力學問題。就是根據測得的蛋白質的一級序列預測由Anfinsen原理決定的特定的空間結構。蛋白質氨基酸序列,特別是編碼蛋白質的核苷酸序列的測定現在幾乎已經成為常規技術,從互補DNA(cDNA)序列可以根據“三聯密碼”推定氨基酸序列,這些在上一世紀獲得重大突破的分子生物學技術,大大加速了蛋白質一級結構的測定。目前蛋白質資料庫中已經存有大約17萬個蛋白的一級結構,但是測定了空間結構的蛋白大約只有1.2萬個,這中間有許多是很相似的同源蛋白,而真正不同的蛋白只有1000多個。隨著人類基因組計劃的勝利完成,解讀了人類DNA的全序列,蛋白質一級結構的數據增長必定會出現爆炸的態勢,而空間結構測定的速度遠遠滯后,因此二者之間還會形成更大的距離,這就更需要進行蛋白質結構的預測。
