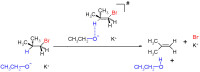
雙分子消除反應
雙分子消除反應
雙分子消除反應(又名E2反應,E代表Elimin 而由於反應為一步完成,與二種反應物濃度皆有關,在反應動力學上是屬於二級反應。但E2反應則不然,E2反應具有立體特異性,反應中的氫必須與離去基在平面的異邊(an
雙分子消除反應(又名E2反應,E代表Elimination,而2代表反應速率受到二個化合物濃度的影響),為消除反應的一項反應機構,由於反應為一步形成,與二種反應物濃度皆有關,在反應動力學上是屬於二級反應,故又稱為“雙分子消除反應”。
雙分子消除反應為1920年代,克里斯托夫·英果爾德(Christopher Kelk Ingold)與羅伯特·魯賓遜((Robert Robinson)展開了一連串有機化學的研究,提出了許多現代有機化學里的觀念,像是親核性、親電性、SN1反應、SN2反應、E1反應、E2反應等等都是在他們研究后先後提出來的嶄新概念,這些概念的提出對揭示有機反應內在機理從而實現控制有機反應起到了巨大的促進作用,而E2反應,就是他們提出越來解釋消除反應的其中一項反應機構。
如同SN2反應,反應由一步完成,但不同的是由鹼來拉走質子,而並不是當作親核試劑,鹼進攻β-氫,並與離去基同時離去,生成烯烴。而由於反應為一步完成,與二種反應物濃度皆有關,在反應動力學上是屬於二級反應。
而因為E2反應不需侵入重圍,攻擊之中的碳原子,只需從旁拉走一個質子,因此立體阻礙在此並不如SN2反應般發生影響,因此在一、二、三級受質皆可發生反應,而因為E2反應不會產生碳陽離子,故不會發生重排現象。E2反應為一步反應,因此鹼的強弱對其反應速率有很顯著的影響,越強的鹼能使反應進行越快,而對於離去基來說,E2反應需要好的離去基方能進行反應,但離去基的影響相較於E1反應並沒有如此敏感,但是離去基越強,皆能增加E1及E2的反應速率。雙分子消除反應與單分子消除反應和單分子親核取代反應互為競爭反應。但由於E1反應較難發生,所有條件都必須恰到好處,(三級受質、弱鹼、極好的離去基),如果三個條件有一樣稍微不同,反應都較傾向於遵循E2反應機構。因此,因E2反應較為常見,特別是在三級受質的情況下,能使反應迅速發生。在E1反應中,區域選擇性使其反應遵循查依采夫規則,得到的產物會出現順、反二種順反異構物。但E2反應則不然,E2反應具有立體特異性,反應中的氫必須與離去基在平面的異邊(antiperiplanar),因此只會得到其中一種立體異構物。
最後可將上述的結果整理成表格如下:
| 受質 | 親核試劑 | 離去基 |
| 一級受質:只發生E2反應 | 強親核試劑:E2 | 壞的離去基:皆不發生 |
| 二級受質:E2 | 溫和的親核試劑:E1與E2 | 好的離去基:E1與E2(E2較多) |
| 三級受質:E1與E2 | 弱的親核試劑:E2 | 極好的離去基:E1 |
E2反應與SN2反應的比較:
| E2反應 | SN2反應 | |
| 反應類型 | 消除反應 | 取代反應 |
| 反應級數 | 二級反應 | 二級反應 |
| 立體障礙 | 不受影響 | 受影響 |
| 親核試劑 | 隨試劑鹼度上升而反應增快 | 隨親核基強度上升而反應增快 |
| 離去基 | 離去基越好反應越快 | 離去基越好反應越快 |