化學動力學
化學動力學
化學動力學(chemical kinetics),是研究化學反應過程的速率和反應機理的物理化學分支學科,它的研究對象是物質性質隨時間變化的非平衡的動態體系。
它的研究對象是性質隨時間而變化的非平衡的動態體系。它的主要研究領域包括:分子反應動力學、催化動力學、基元反應動力學、宏觀動力學、微觀動力學等,也可依不同化學分支分類為有機反應動力學及無機反應動力學。化學動力學往往是化工生產過程中的決定性因素。

(圖)相關書籍
它的主要研究領域包括:分子反應動力學、催化動力學、基元反應動力學、宏觀動力學、表觀動力學等,也可依不同化學分支分類為有機反應動力學及無機反應動力學。化學動力學往往是化工生產過程中的決定性因素。時間是化學動力學的一個重要變數。經典的化學動力學實驗方法不能製備單一量子態的反應物,也不能檢測由單次反應碰撞所產生的初生態產物。體系的熱力學平衡性質不能給出化學動力學的信息,全面認識一個化學反應過程並付諸實現,不能缺少化學動力學研究。
原則上,如果能從量子化學理論計算出反應體系的正確的勢能面,並應用力學定律計算具有代表性的點在其上的運動軌跡,就能計算反應速率和化學動力學的參數。但是,除了少數很簡單的化學反應以外,量子化學的計算至今還不能得到反應體系的可靠的、完整的勢能面。因此,現行的反應速率理論仍不得不借用經典統計力學的處理方法。這樣的處理必須作出某種形式的平衡假設,因而使這些速率理論不適用於非常快的反應。儘管對於衡假設的適用性研究已經很多,但完全用非平衡態理論處理反應速率問題尚不成熟。
經典的化學動力學實驗方法不能製備單一量子態的反應物,也不能檢測由單次反應碰撞所產生的初生態產物。分子束(即分子散射),特別是交叉分子束方法對研究化學元反應動力學的應用,使在實驗上研究單次反應碰撞成為可能。分子束實驗已經獲得了許多經典化學動力學無法取得的關於化學元反應的微觀信息,分子反應動力學是現代化學動力學的一個前沿陣地。
體系的熱力學平衡性質不能給出化學動力學的信息。例如,對以下反應:2H2(氣)+O2(氣)─→2H2O(氣)儘管H2、O2和H2O的所有熱力學性質都已準確知道,但只能預言H2和O2生成H2O的可能性,而不能預言H2和O2在給定的條件下能以什麼樣的反應速率生成H2O,也不能提供H2分子和O2分子是通過哪些步驟結合為H2O分子的信息。所以,全面認識一個化學反應過程並付諸實現,不能缺少化學動力學研究。
20世紀前半葉,大量的研究工作都是對這些參數的測定、理論分析以及利用參數來研究反應機理。但是,反應機理的確認主要依賴於檢出和分析反應中間物的能力。20世紀後期,自由基鏈式反應動力學研究的普遍開展,給化學動力學帶來兩個發展趨向:一是對元反應動力學的廣泛研究;二是迫切要求建立檢測活性中間物的方法,這個要求和電子學、激光技術的發展促進了快速反應動力學的發展。對暫態活性中間物檢測的時間解析度已從50年代的毫秒級提高到皮秒級。
化學動力學的研究方法有:
①唯象動力學研究方法,也稱經典化學動力學研究方法,它是從化學動力學的原始實驗數據──濃度c與時間t的關係──出發,經過分析獲得某些反應動力學參數──反應速率常數k、活化能Ea、指前因子A。用這些參數可以表徵反應體系的速率特徵,常用的關係式有:
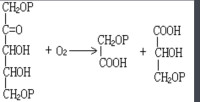
化學動力學
化學動力學參數是探討反應機理的有效數據。20世紀前半葉,大量的研究工作都是對這些參數的測定、理論分析以及利用參數來研究反應機理。但是,反應機理的確認主要依賴於檢出和分析反應中間物的能力。20世紀後期,自由基鏈式反應動力學研究的普遍開展,給化學動力學帶來兩個發展趨向:一是對元反應動力學的廣泛研究;二是迫切要求建立檢測活性中間物的方法,這個要求和電子學、激光技術的發展促進了快速反應動力學的發展。對暫態活性中間物檢測的時間解析度已從50年代的毫秒級變為皮秒級。
(圖)化學動力學
在60年代,對化學反應進行分子水平的實驗研究還難以做到。經典的化學動力學實驗方法不能製備單一量子態的反應物,也不能檢測由單次反應碰撞所產生的初生態產物。分子束(即分子散射),特別是交叉分子束方法對研究化學元反應動力學的應用,使在實驗上研究單次反應碰撞成為可能。分子束實驗已經獲得了許多經典化學動力學無法取得的關於化學元反應的微觀信息,分子反應動力學是現代化學動力學的一個前沿陣地。它應用現代物理化學的先進分析方法,在原子、分子的層次上研究不同狀態下和不同分子體系中單分子的基元化學反應的動態結構,反應過程和反應機理。它從分子的微觀層次出發研究基元反應過程的速率和機理,著重於從分子的內部運動和分子因碰撞而引起的相互作用來觀察化學基元過程的動態學行為。中科院大連化學物理研究所分子反應動力學國家重點實驗室在這方面研究有突出的貢獻。
③網路動力學研究方法,它對包括幾十個甚至上百個元反應步驟的重要化工反應過程(如烴類熱裂解)進行計算機模擬和優化,以便進行反應器最佳設計的研究。

(圖)化學動力學
(一)反應速度、反應速度常數、反應級數
1、反應速度
反應速度常用單位時間內、單位體積中反應物濃度的減少或生成物濃度的增加來表示:
-dC/dt,式中C為t時間反應物的濃度,負號表示反應物的濃度逐漸減少。
2、反應速度常數
根據質量作用定律,反應速度與反應物濃度之間有下列關係:
-dC/dt=KCn(4-1)
式中K為反應速度常數,是指各反應物為單位濃度時的反應速度,單位為[時間]-1,其大小與反應溫度有關。K值越大,表示反應物的活潑程度越大,藥物製劑越不穩定。
3、反應級數
式(4-1)中的n為反應級數,是各反應物所有濃度項的總和,表示反應速度隨反應物濃度的變化而改變的方式。大多數藥物的降解過程可以用零級和假零級反應、一級和假一級反應來處理。
(1)零級和假零級反應
若反應速度與反應物的濃度無關,這種反應稱為零級反應。如光化反應中反應物對光的吸收,其反應速度與反應物的濃度無關。
混懸液中藥物的降解僅與溶液相中的藥物量即藥物的溶解度有關,而與混懸的固體藥量無關;當藥物降解后,固體相中的藥物就溶解補充到溶液相中,保持溶液中的藥量不變;而藥物的溶解度為常數,故這類降解反應也為零級反應,但與真正的零級反應有所不同,故為假零級反應。
根據式(4-1)可知,零級反應的n=0,則零級反應速度方程式為:
-dC/dt=K(4-2)
其積分式為:C=-Kt+C0(4-3)
(2)一級反應和假一級反應
若反應速度與反應物濃度的一次方成正比,則稱為一級反應。大多數藥物以一級反應降解。
根據式(4-1)可知,一級反應的n=1,則零級反應速度方程式為:
-dC/dt=KC(4-4)
其積分式為:lgC=-(Kt/2.303)+lgC0(4-5)
二種或二種以上反應物參加反應,當一種反應物濃度遠超過另一種反應物濃度,或在反應中濃度基本不變時,該反應物的濃度可近似地看成為常數,故從形式上看為一級反應,但實際上有二種反應物參加反應,稱為假一級反應。如用緩衝溶液調節pH值時,緩衝溶液中離子濃度(如H+)遠高於藥物濃度,其降解反應為假一級反應。
(二)有效期、半衰期
1、有效期
藥劑學中的有效期是指製劑中的藥物降解10%所需的時間,常用t0.9表示。
根據(4-5)可得,一級反應的有效期為:
t0.9=0.1054/K(4-6)
2、半衰期
藥劑學中的半衰期是指製劑中的藥物降解50%所需的時間,常用t1/2表示。
根據(4-5)可得,一級反應的有效期為:
t1/2=0.693/K(4-7)

(圖)工作的焦耳
化學動力學與化學熱力學不同,不是計算達到反應平衡時反應進行的程度或轉化率,而是從一種動態的角度觀察化學反應,研究反應系統轉變所需要的時間,以及這之中涉及的微觀過程。化學動力學與熱力學的基礎是統計力學、量子力學和分子運動論。
它的研究對象是性質隨時間而變化的非平衡的動態體系。化學熱力學是物理化學和熱力學的一個分支學科,它主要研究物質系統在各種條件下的物理和化學變化中所伴隨著的能量變化,從而對化學反應的方向和進行的程度作出準確的判斷。化學熱力學是建立在三個基本定律基礎上發展起來的。熱力學第一定律就是能量守恆和轉化定律,它是許多科學家實驗總結出來的。
動力學是理論力學的分支學科,研究作用於物體的力與物體運動的關係。動力學的研究對象是運動速度遠小於光速的宏觀物體。原子和亞原子粒子的動力學研究屬於量子力學;可以比擬光速的高速運動的研究則屬於相對論力學。動力學是物理學和天文學的基礎,也是許多工程學科的基礎。許多數學上的進展常與解決動力學問題有關,所以數學家對動力學有濃厚的興趣。
反應速率是化學反應快慢程度的量度,廣義地講是參與反應的物質的量隨時間的變化量的絕對值,分為平均速率與瞬時速率兩種。平均速率是反應進程中某時間間隔(Δt)內參與反應的物質的量的變化量,可用單位時間內反應物的減少量或生成物的增加量來表示;瞬時速率是濃度隨時間的變化率,即濃度-時間圖像上函數在某一特定時間的切線斜率。
反應平衡:熱力學研究反應達到反應平衡時的狀態。在可逆反應中,反應物與產物達到動態平衡,正向反應與逆向反應的速率相等,反應物與產物的濃度不再發生變化。它可通過哈伯法合成氨、化學振蕩反應如Belousov-Zhabotinsky反應(B-Z反應)、碘鍾反應等多組分反應過程來進行演示。
反應機理:雖然化學方程式中各物質的計量比看似簡單,但微觀上,一個化學反應通常是經過幾步完成的,描述化學反應的微觀過程的化學動力學分支稱為反應機理。反應機理中,每一步反應稱作基元反應,基元反應中反應物的分子數總和稱為反應分子數。反應機理由一個或多個基元反應所組成,這些基元反應的凈反應即為表觀上的化學反應。
化學動力學是研究化學反應速率(rate of reaction)和反應機理(mechanism of reaction)的化學分支學科。化學動力學的主要內容包括以下幾點:
1)確定化學反應的速率以及溫度、壓力、催化劑、溶劑和光照等外界因素對反應速率的影響。
2)研究化學反應機理,揭示化學反應速率本質。
3)探求物質結構與反應能力之間的關係和規律。
通過化學動力學的研究,可以知道如何控制反應條件,提高主反應的速率,增加產品產量,抑制副反應的速率,減少原料消耗,減少副產物,提高純度,提高產品質量。化學動力學也研究如何避免危險品的爆炸、材料的腐蝕、產品的變質與老化等問題。所以化學動力學的研究有理論與實踐上的重大意義。
