摩爾電導率
摩爾電導率
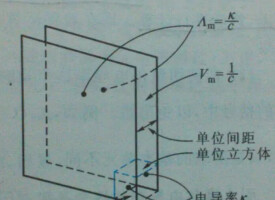
摩爾電導率Λm(molar conductivity)是指把含有1mol電解質的溶液置於相距為單位距離的電導池的兩個平行電極之間,這時所具有的電導。
引入摩爾電導率的概念是很有用的。因為一般電解質的電導率在不太濃的情況下都隨著濃度的增高而變大,因為導電粒子數增加了。為了便於對不同類型的電解質進行導電能力的比較,人們常選用摩爾電導率,因為這時不但電解質有相同的量(都含有1mol的電解質),而且電極間距離也都是單位距離。當然,在比較時所選取的電解質基本粒子的荷電荷量應相同。
摩爾電導率定義示意圖
Λm=k·Vm=k/c
其中k的單位為S·m-1 ,c的單位為mol·m-3,所以摩爾電導率Λm的單位為S·m2·mol-1
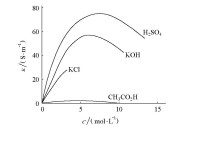
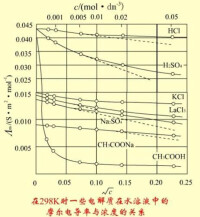
當濃度降低時,粒子之間相互作用減弱,正、負離子遷移速率加快,溶液的摩爾電導率必定升高。但不同的電解質,摩爾電導率隨濃度降低而升高的程度也大不相同。當濃度降低到一定程度后,強電解質的摩爾電導率接近為一定值,而弱電解質的值仍在繼續變化。
電解質在水溶液中的摩爾電導率隨濃度的變化
其中β在一定溫度下,對於一定的電解質和溶劑而言是一個常數。Λm(∞)為溶液在無限稀釋時的摩爾電導率,又稱為極限摩爾電導率。