人工血液
人工血液
人工血液,也稱人工替代血液,是利用和血紅蛋白相同的加工處理方法,維持血壓不變,在扮演搬運各種物質角色的白蛋白中放入血紅素分子,製成白蛋白血紅素,這就是人工血液,動物實驗顯示這種人工血液可把肺部呼吸的氧氣輸送到體內各個組織器官,在澳洲一婦女被用人工合成血液救活,尚屬世界首例。
人工血液
1、人體血液由血漿、紅細胞、白細胞和血小板組成,成分非常複雜,要製造出一種完全代替血液的溶液非常困難,但研製一種臨時替代品,在急需情況下能短時間內代替血液中某種成分的作用卻是可行的。
2、人工血液的傳統製造法是將過期紅血球內的血紅素抽出使用。早期直接用抽出的血紅素試驗,發現在注入血流中經數小時后就會分解成兩個α、β次單位,然後很快地這些次單位會積存在腎臟,造成毒性;另一個問題是人工血紅素如果不經過改造,雖然可以和氧結合,但釋放氧到組織的能力不佳,結果也不得理想。
3、人們通過這種試驗就想到通過化學方法把兩個α、β分子連結得更穩固些。這種產品對熱很穩定,可用高熱殺死病毒和其它感染病源,而且釋放氧的功能也很不錯,同時這種經改造過的人工血紅素還可以把適當的治療藥物用化學方法鍵合到人工血紅素內。最新的人工血紅素製造原理是把血紅素基因轉植到細菌體內,利用細菌作為製造工廠,再進行大量複製。採用這種技術來生產血紅素的優點是被轉植到細菌體內的基因可以作局部的修改,使生產出來的血紅素在穩定性和釋氧能力等方面都能得到適當的調整。
(圖)人工血液
HBOC與血液大致類似,它們呈暗紅色或紫紅色,由經滅菌處理的血紅蛋白製成,血紅蛋白的來源有很多:
人工血液利用了被動擴散的原理
1、來自過期的人類血液的紅細胞
2、來自牛血的紅細胞
3、可產生血紅蛋白的轉基因細菌
4、人類胎盤
醫生不能直接將血紅蛋白注射到人體中。當血紅蛋白進入血細胞后,完全可以起到攜帶和釋放氧氣的功能。但如果沒有細胞膜的保護,血紅蛋白的分解速度會非常快,而這可能導致腎臟嚴重損傷。科學家還研究了由類脂物、膽固醇或脂肪酸製成的人造膜包裹血紅蛋白的HBOC。有一種名叫MP4的HBOC就是由聚乙二醇包覆的血紅蛋白製成的。HBOC的工作方式與普通紅細胞大致相同。HBOC分子漂浮在血漿中,從肺中獲得氧氣並將其釋放到毛細血管中。這些分子比紅細胞小得多,因此可以到達紅細HBOC和PFC均比紅細胞小得多胞無法流經的地方,如極端腫脹的組織或惡性腫瘤周圍的異常血管等。大多數HBOC在人體血液中停留一天左右——比普通紅細胞100天的循環周期短得多。HBOC也有一些副作用。改進型血紅蛋白分子可進入細胞間的微小空間並結合一氧化氮,一氧化氮對於維持血壓非常重要。這會導致病人的血壓飆升。HBOC還可導致腹部不適和絞痛,這很可能是由於自由基的釋放,而自由基是一種對細胞有害的分子。某些HBOC還會導致眼睛暫時變紅或皮膚潮紅。
與HBOC不同,PFC通常是白色的,完全由人工合成。它們與碳氫化合物很相似,但它們包含的是氟而不是碳。 PFC具有化學惰性,但在攜帶溶解氣體方面很出色。它們能夠比水或血漿多攜帶20%至30%的氣體,如果存在更多的氣體,它們還能攜帶得更多。出於該原因,多聚血紅蛋白HBOC醫生在使用PFC的同時會進行輸氧。但是,多餘的氧氣可導致人體內自由基的釋放。研究人員正在研究PFC能否在沒有額外氧氣的條件下工作。PFC既油又滑,因此在使用時必須先進行乳化處理或懸浮在某種溶液中。PFC一般與通常用於靜脈注射的其他藥物混合使用,如卵磷脂或白蛋白。這些乳化劑最終會在離開血液循環系統時分解,肝臟和腎臟將其從血液中除去,肺會像呼出二氧化碳一樣,將PFC呼出體外。有時,在機體分解和呼出PFC時,人體會產生類似流感的癥狀。與HBOC類似,PFC體積很小,可以到達紅細胞無法到達的地方。出於該原因,有些醫院研究了是否可以使用PFC將氧氣送過腫脹的腦組織,以此治療創傷性腦損傷(TBI)。製藥公司正在測試PFC和HBOC在某些特定醫療情況下的療效,但它們還有很多潛在用途,例如:
1、在創傷失血后,恢復人體供氧能力,特別是在急救室和戰場上
2、預防在手術過程中突然急需輸血
3、維持通向腫瘤組織的氧流量,以使化療更為有效
4、治療會導致紅細胞數量減少的貧血病
5、向受到鐮狀細胞貧血症影響的身體腫脹組織輸送氧氣.
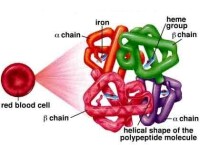
1、血紅素的分子量約為64500 dalton,主要存在於紅血球中,由四個胜肽鏈所組成,分別為二個α鏈與二個β鏈,每一個α鏈由141個氨基酸所組成,而β鏈則為146個氨基酸所組成。每條α鏈及β鏈上皆有一個原血紅素基與之相連,其中的亞鐵離子(Fe2+)可以利用配位鍵的方式與一個氧分子結合,能夠可逆地行使攜氧與釋氧的功能,因此每一個血紅素分子最多可以攜帶四個氧分子。
2、在人體內當紅血球行經肺臟時,由於肺泡里的氧分壓高達100毫米汞柱(mmHg),使得紅血球里的每一血紅素分子可以充分地攜帶氧氣。當攜氧的紅血球行經人體的各部分組織或器官時,由於氧分壓降至約40毫米汞柱,紅血球里的血紅素分子便將其所攜帶的氧分子釋放出來,以參與附近細胞的新陳代謝作用。血紅素與氧分子的親和力,與紅血球內的一重要分子(2,3-DPG)有相當密切的關係。經由純化過程所取得的血紅素溶液,由於紅血球被打破,造成2,3-DPG分子的流失,導致血紅素對氧的親和力過高,而降低了其在人體組織或器官中的釋氧功能。因此若以血紅素為基質來製備人工替代血液,必須對純化出來的血紅素溶液做適當的物理或化學修飾,以符合人體的生理要求。目前以血紅素為基材發展的人工替代血液,大致可分為包覆型人工替代血液、基因重組型人工替代血液與聚合型人工替代血液等。
a、包覆型人工替代血液:以磷脂質經由乳化技術將血紅素包覆起來,形成直徑約100~200奈米大小的顆粒,如此可以避免血紅素在體內被快速分解掉,增加其在人體血液循環中的半衰期,且在人體膠體滲透壓的限制下,可以有正常的血紅素濃度。在包覆過程中同時也把2,3-DPG分子包覆在磷脂質裡面,以調控血紅素分子對氧分子的親和力。
b、基因重組型人工替代血液:主要是利用基因技術,將血紅素的α或β鏈的基因轉殖到大腸桿菌裡面,由大腸桿菌來表現,製造出血紅素分子。利用基因技術可以改變α或β鏈上某些特定的氨基酸,例如將β鏈上第108個氨基酸,由原來的天門冬胺酸改變成離胺酸,可以使得血紅素對氧的親和力降低。
c、聚合型人工替代血液:又可分為分子內部交聯型血紅素、分子與分子間交聯型血紅素與共軛交聯型血紅素。
3、分子內部交聯型血紅素:血紅素分子內部的交聯可以用PLP(pyridoxyl 5'-phosphate)分子代替2,3-DPG分子,作為修飾血紅素對氧分子親和力的交聯劑。由於PLP和2,3-DPG對脫氧狀態的血紅素分子結合的位置相同,因此可以穩定其去氧結構,使血紅素對氧的親和力降低。這樣的分子內部交聯也同時穩定了血紅素的四聚體結構,避免在人體血液循環過程中被快速分解掉,因此可以改善血紅素分子在人體內滯留的半衰期。
4、分子與分子間交聯型血紅素:分子內部交聯后的血紅素分子,若進一步以另一交聯劑將血紅素分子與分子間交聯起來,則可以有效地增加其在人體血液循環中的半衰期達六至七倍。目前較常用的交聯劑為戊二醛。聚合血紅素最重要的就是控制其分子量分佈及適當的攜氧能力,較適當的分子量大小約在20萬~40萬dalton,以不超過50萬dalton為佳,也就是相當於二至八個血紅素分子聚合的大小。若聚合程度過高,則聚合后的血紅素溶液黏度會過大,導致血液流變性質的改變。若血紅素分子聚合程度過低,則無法得到適當的攜氧能力以及在人體內的適當半衰期。然而戊二醛與血紅素分子進行的聚合反應很快,所製造出來的聚合血紅素分子量分佈往往相當廣,容易造成許多過聚合的高分子聚合物。此外,戊二醛聚合血紅素無法在儲存及加熱過程中維持穩定結構,容易釋放出對人體有害的戊二醛分子,因此戊二醛並非製造聚合血紅素最佳的交聯劑。
5、共軛交聯型血紅素:利用交聯劑將血紅素分子以共價鍵結的方式鍵結在水溶性高分子鏈上,目的除了增加血紅素分子的體積以減緩血紅素分子由腎絲球體漏出外,亦可避免血液中其它蛋白質的吸附,以降低人體免疫系統的攻擊。
人工血液
2、就在這時,該院外傷醫生馬克·菲茨傑拉德忽然想到使用血液替代品——HBOC-2-1(血紅蛋白氧載體),這是一種利用牛的血漿人工合成的血液替代品,由美國軍方研製而成的。菲茨傑拉德醫生說:“我們想到使用血液替代品,但只有美國才有,而且只有10個單位。在取得聯繫后,美國方面把10個單位的產品都給了我們。”在輸入了替代血液后,科克利的血紅蛋白逐漸上升,她漸漸蘇醒,如今已經恢復了健康。
3、菲茨傑拉德醫生曾參與了美國的人工合成血液研製,因此對這種產品非常熟悉。採用人工合成血液救治患者,對於世界性的血液短缺有重要啟示,這種替代血液不需要血型的匹配,不需要冷藏,在常溫狀態下可以保持3年之久,對於缺乏足夠血源的偏遠地區而言,這可能是挽救失血患者生命的最佳選擇。