△H
化學反應過程中吸收或放出的熱量
在恆溫恆壓的條件下,化學反應過程中吸收或放出的熱量稱為反應熱,稱之為ΔH,單位kJ·mol。
,△H在等壓且只做體積功條件下
焓的物理意義可以理解為恆壓和只做體積功的特殊條件下,,即反應的熱量變化。因為只有在此條件下,焓才表現出它的特性。例如恆壓下對物質加熱,則物質吸熱后溫度升高,,所以物質在高溫時的焓大於它在低溫時的焓。又如對於恆壓下的放熱化學反應,,所以生成物的焓小於反應物的焓。
在化學反應中,因為H是狀態函數,所以只有當產物和反應物的狀態確定后,ΔH才有定值。
在發生化學反應時,首先要吸收能量,使反應物的化學鍵破壞,這一過程需要吸收反應物鍵能那麼多的能量。然後再形成新的化學鍵,這一過程是釋放能量的,釋放的能量為生成物的鍵能.
所以當△H小於0,是一個放熱過程,吸收的能量小於釋放的能量
反之就是△H大於0,就是吸熱過程
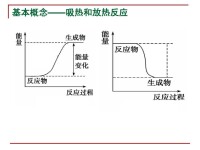
吸熱反應
(2)物質燃燒時,可燃物物質的量越大,燃燒放出的熱量越多;
(3)等量的可燃物完全燃燒所放出的熱量肯定比不完全燃燒所放出的熱量多;
(4)產物相同時,氣態物質燃燒放出的熱量比等量的固態物質燃燒放出的熱量多;
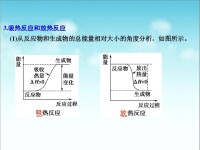
放熱反應
(5)生成等量的水時強酸的稀溶液反應比弱酸和強鹼或弱鹼和強酸或弱酸和弱鹼的稀溶液反應放出的熱量多;
(6)對於可逆反應,因反應不能進行完全,實際反應過程中放出或吸收的能量要小於相應熱化學方程式中的數值。例如:2SO2(g) + O2(g)≒2SO3(g);△H= - 197kJ/mol,則向密閉容器中通入2mol SO2和1 mol O2,反應達到平衡后,放出的熱量要小於197kJ。
畫出化學變化過程中的能量變化圖后,依據反應物的總能量與生成物的總能量的高低關係可以很方便地比較△H的大小。如圖所示:
在比較反應放熱或吸熱大小時,只比較數值大小,沒有正、負之分;而比較△H的大小,則要區分正、負,當△H > 0時,反應熱數值越大,△H越大,當△H < 0時,反應熱數值越大,△H越小。
注意:對於一個確定的化學反應,其焓變ΔH保持不變
