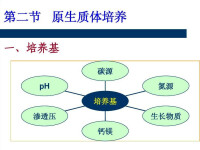
原生質體培養
原生質體培養
原生質體(protoplast):脫去全部細胞壁的細胞叫原生質體,是一生物工程學概念。原生質體是由質膜所包圍的具有生活力的”裸露細胞“。
原生質體培養:對離體植物的原生質體進行培養,形成完整植株的培養技術。
①無細胞壁障礙,可以方便地進行有關遺傳操作,並可以對膜,細胞器等進行基礎研究。
②具有全能性,並能進行人工培養發育成完整植株。
③原生質體適合進行誘導融合形成雜種細胞。
主要來源:植物的葉片,根尖,花粉,愈傷組織細胞等。
機械分離法:常用於分離藻類原生質體,採用滲透方法使細胞發生質壁分離,用刀把細胞壁切破,使原生質體流出。(手工操作難度大,得率低,費時費力)
酶解分離法:用酶(瓊脂酶,果膠酶,纖維素酶等)將細胞壁分解。(條件溫和,原生質體完整性好,活力高,得率高)因此原生質體製備多採用酶解法,此法操作過程分為:取材消毒,酶解製備,原生質體收集。
原生質體的純化方法:沉降法、漂浮法、界面法。
即檢驗所獲得的原生質體是否是真正的原生質體
(1)低滲脹破法:把原生質體放入低滲透溶液中,在顯微鏡下觀察原生質體從低滲溶液中吸水脹破的過程。如果是真正的原生質體,因為沒有細胞壁,這樣在脹破后留下的殘跡應該是無形的。如果原生質體還帶有部分細胞壁,則原生質體從無壁部分吸水向外膨脹直至脹破,破碎后留下的殘跡仍保持半圓形的細胞壁。
(2)熒光染色法:將原生質體放入離心管中,加入0.7mol/L甘露醇配置的0.05%~0.1%熒光增白劑溶液,染色5~10min,離心、洗滌除去多餘的染料,在熒光顯微鏡下觀察。綠色光顯示纖維素的存在,發出紅色光的是沒有纖維素的真正的原生質體
檢驗原生質體是活細胞還是死細胞
染色法:
①二乙酸熒光素(FDA)法:FDA本來沒有熒光,當其進入細胞后被脂酶分解為具有熒光的極性物,不能透過質膜,而是留在細胞內發出熒光。因此能發出熒光的是具有活性的原生質體。
②酚藏花紅染料法:具有活力的原生質體吸收染料顯紅色;無活力的不能吸收染料而顯示白色。
③伊文思藍染色法:有活力的細胞不能吸收染料為無色;而沒活力的細胞則能吸收染料顯藍色。
其他法:①胞質環流法②滲透壓變化③氧電極法④形態觀察法
原生質體培養
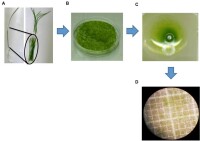
原生質體培養
主要有液體淺層培養法、液體懸滴培養、固體平板法、固液雙層培養法(應用最廣泛)、瓊脂糖珠培養法。
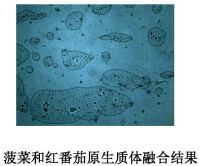
原生質體融合
經原生質體培養的植株再生一般經過細胞壁再生,細胞分裂成細胞團、愈傷組織(或胚狀體)、植株再生這幾個過程。
①細胞壁再生:原生質體在合適條件下短時間內開始膨脹,葉綠體重排,並開始合成新的細胞壁,進而由球形變成橢圓形。
②細胞分裂:不同的植物細胞分裂時間不同。為了細胞能持續分裂,應注意及時添加新鮮培養液。
④植株再生,誘發芽和根的生成。誘導胚狀體:在原生質體培養時直接誘發胚狀體的生長,從而發育成完整植株。
①植物原生質體是細胞無性系變異和突變體篩選的重要來源;
②植物原生質體是細胞融合工作的基礎;
③植物原生質體是植物遺傳工程的理想受體和遺傳飾變的理想材料;
④在細胞生物學與遺傳理論研究上的應用。
