甲醇燃料電池
質子交換膜燃料電池中的一類
直接甲醇燃料電池屬於質子交換膜燃料電池(PEMFC)中之一類,直接使用甲醇水溶液或蒸汽甲醇為燃料供給來源,而不需通過甲醇、汽油及天然氣的重整制氫以供發電。相較於質子交換膜燃料電池(PEMFC),直接甲醇燃料電池(DMFC)具備低溫快速啟動、燃料潔凈環保以及電池結構簡單等特性。這使得直接甲醇燃料電池(DMFC)可能成為未來攜帶型電子產品應用的主流。
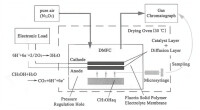
DMFC單電池主要由膜電極、雙極板、集流板和密封墊片組成。由催化劑層和質子交換膜構成的膜電極是燃料電池的核心部件,燃料電池的所有電化學反應均通過膜電極來完成。質子交換膜的徠主要功能是傳導質子阻隔電子,同時作為隔膜防止兩極燃料的互串。催化劑的主要功能是降低反應的活化過電位,促進電極反應迅速進行。使用較多的是Pt基負載型催化劑,如Pt/C催化劑或PtM/C合金催化劑等。
燃料電池的核心組件主要是由陽極、陰極和電解質膜組成,而電極又由擴散層和催化層組成,每部分作用如下:
(1)催化層催化層是發生電化學反應的場所,約佔膜電極成本的54%,而膜電極約佔整個燃料電池成本的84%。因此,如何降低催化劑的載量,製備低成本高性能高活性的燃料電池催化劑是至關重要的。同時,發明的噴塗方法,使催化層的催化劑載量由4mg/cm降到約0.014mg/cm,更好的緩解因為催化劑的價格制約質子交換膜燃料電池的發展。
(2)擴散層擴散層作為電子導電的良導體,其主要作用是保證反應物能均勻到達催化層參加電化學反應。質子交換膜燃料電池的擴散層主要是碳紙或碳布。碳紙使用前要進行憎水化處理並且使用碳粉對其進行整平。
(3)電解質膜電解質膜的性能將直接影響到電池的內阻以及電池的開路電壓,在選用電解質膜時,一般要求電解質膜具有比較好的機械強度和耐溫性能、高的化學穩定性、高的離子電導率。
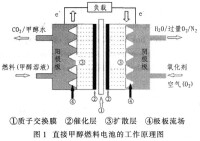
DMFC的基本原理如圖1所示:從陽極通入的甲醇在催化劑的作用下解離為質子,並釋放出電子,質子通過質子交換膜傳輸至陰極,與陰極的氧氣結合生成水。在此過程中產生的電子通過外電路到達陰極,形成傳輸電流並帶動負載。與普通的化學電池不同的是,燃料電池不是一個能量存儲裝置,而是一個能量轉換裝置,理論上只要不斷地向其提供燃料,它就可向外電路負載連續輸出電能
直接甲醇燃料電池的工作原理如下:
陽極:CH3OH+H2O=CO2+6H+6e
陰極:1.5O2+6H+6e =3H2O
總電極反應:CH3OH+1.5O2 =CO2 +2H2O
甲醇燃料電池
直接使用甲醇水溶液或蒸汽甲醇為燃料供給來源,而不需通過甲醇、汽油及天然氣的重整制氫以供發電。相對於質子交換膜燃料電池(PEMFC),直接甲醇燃料電池(DMFC)具備低溫快速啟動、燃料潔凈環保以及電池結構簡單等優點。這使得直接加入甲醇燃料電池(DMFC)可能成為未來攜帶型電子產品應用的主流。這種電池的期望工作溫度為120℃。不過,這種增加的成本與可以方便地使用液體燃料和無須進行重整便能工作相比則不值一提。
如果想把DMFC發展成為一項成功的燃料電池技術,需要開發出兩種關鍵材料:電極催化劑和電解質膜,這也是DMFC所面臨的兩個巨大挑戰。DMFC的商業化受到兩個條件的限制,其中一個主要原因是甲醇陽極反應的動力學速度比氫氣要緩慢很多;另一個原因是甲醇會透過電解質膜,在陰極上發生氧化反應,降低了電池電壓和燃料的利用率。因此,必須研究和開發新的陽極催化劑,有效地提高甲醇的電化學氧化速度;研究和製備低甲醇透過的電解質膜以及耐甲醇的陰極催化劑,這樣,才能使直接甲醇燃料電池在運輸領域、攜帶型工具和分散式電站等方面的實用化取得顯著的進步。
優勢是體積小巧,燃料使用便利,潔凈環保,理論能量比較高,缺陷是能量轉化率低,性能衰減快,成本高。
影響DMFCs的性能的主要因素有;(a)膜厚度,(b)電池溫度,(c)甲醇濃度,(d)燃料的pH值,(e)催化劑活性,(f)電極結構,(g)甲醇滲透燃料的利用率低,在陰極形成混合電位和(h)陰極擴散層的聚偏氟乙烯(PTFE)的含量。其中,催化劑活性低是影響DMFC性能最為關鍵的因素。
原因有:(1)電催化劑活性低,導致化學反應速率降低;(2)Pt易吸附甲醇氧化的含氧活性中間體COx導致催化劑中毒;(3)Pt等金屬價格昂貴;(4)低溫條件下運行時,在陽極會產生高電位,降低轉換效率;考慮到以上這些關鍵因素,研究者們現在致力於發展耐久性好,價格低廉,並且有較高活性和穩定性的陽極甲醇氧化(MOR)和陰極氧氣還原(ORR)催化劑。
採取的主要途徑有:(1)通過Pt與其它貴金屬形成合金降低Pt用量;(2)製備不同形貌的低鉑催化劑,提高催化劑活性;(3)尋找非貴金屬或非金屬催化劑。
甲醇燃料電池
直接甲醇燃料電池是質子交換膜燃料電池的一種變種,它直接使用甲醇而勿需預先重整。甲醇在陽極轉換成二氧化碳,質子和電子,如同標準的質子交換膜燃料電池一樣,質子透過質子交換膜在陰極與氧反應,電子通過外電路到達陰極,並做功。
鹼性條件 總反應式:2CH4O+3O2+4OH-=2CO32-+6H2O
徠正極:3O2+12e–+6H20→12OH–
負極:2CH4O-12e–+16OH~→2CO32-+12H2O
酸性條件CH4+2O2→CO2+2H2O
正極:3O2+12e–+12H+→6H2O
負極:2CH4O-12e–+2H2O→12H++2CO2
這種電池的期望工作溫度為120℃以下,比標準的質子交換膜燃料電池略高,其效率大約是40%左右。
直接甲醇燃料電池是質子交換膜燃料電池的一種變種,它直接使用甲醇而無需預先重整。甲醇在陽極轉換成二氧化碳和氫,如同標準的質子交換膜燃料電池一樣,氫然後再與氧反應。
甲醇氧化
甲醇氧化涉及6電子轉移,過程複雜緩慢。現場紅外光譜檢測發現甲醇在Pt電極上氧化的主要產物有CO、COH、HCOH及H2COH8。為了提高陽極反應的速率,必須深入研究甲醇氧化機理,尤其是甲醇氧化過程中的速度控制步驟。相關的研究較多,一般認為按雙途徑進行。認為其氧化過程分為兩個基本步驟:
①甲醇吸附至催化劑表面並逐步脫氫形成含碳中間產物。
②解離水產生含氧物種,與含碳中間產物反應,並釋放出CO2。
由於Pt在酸性介質中對甲醇具有較好的吸附能力,且具有較好的氧化活性及穩定性,甲醇氧化機理研究一般在Pt基催化劑PtM(M=Pt,Ru,Sn,Mo)表面進行,主要包括如下步驟:
CH3OH+Pt(s)→Pt-CH2OH+H+e
Pt-CH2OH+Pt(s)→Pt2-CHOH+H+e
Pt2-CHOH+Pt(s)→Pt3-COH+H+e
Pt3-COH+Pt(s)→Pt-CO+2Pt(s)+H+e
M(s)+H2O→M-OH+H+e
Pt-CO+M-OH→PtM+CO2+H+e
氧還原
DMFC陰極發生氧還原反應(Oxygen Reduction Reaction,ORR),由於Pt及其合金催化劑對氧還原的催化活性較高,因此是應用最普遍的陰極催化劑。氧氣在Pt電極上的還原反應涉及多個電子的轉移,可能包括多個基元反應。Worblowa等提出可能的氧還原過程為:
Pt+O2→Pt-O2
Pt-O2+H+e→Pt-HO2
Pt-HO2+Pt→Pt-OH+Pt-O
Pt-OH+Pt-O+3H+3e→2Pt+2H2O
1.催化劑
採用貴金屬納米催化劑,成本高。活性及穩定性達不到理想要求
2.質子交換膜
杜邦公司Nafion膜甲醇透過很嚴重,造成燃料浪費,陰極混合電位,性能下降
3.電池集成
針對DMFC的集成技術還不完善
這種電池的期望工作溫度為120℃,比標準的質子交換膜燃料電池略高,其效率大約是40%左右。其缺點是當甲醇低溫轉換為氫和二氧化碳時要比常規的質子交換膜燃料電池需要更多的白金催化劑。不過,這種增加的成本可以因方便地使用液體燃料和勿需進行重整便能工作而相形見絀。直接甲醇燃料電池使用的技術仍處於其發展的早期,但已成功地顯示出可以用作行動電話和膝上型電腦的電源,將來還具有為指定的終端用戶使用的潛力。
