光聲成像
光聲成像
光聲成像(Photoacoustic Imaging, PAI)是近年來發展起來的一種非入侵式和非電離式的新型生物醫學成像方法。當脈衝激光照射到(熱聲成像則特指用無線電頻率的脈衝激光進行照射)生物組織中時,組織的光吸收域將產生超聲信號,我們稱這種由光激發產生的超聲信號為光聲信號。生物組織產生的光聲信號攜帶了組織的光吸收特徵信息,通過探測光聲信號能重建出組織中的光吸收分布圖像。光聲成像結合了純光學組織成像中高選擇特性和純超聲組織成像中深穿透特性的優點,可得到高解析度和高對比度的組織圖像,從原理上避開了光散射的影響,突破了高解析度光學成像深度“軟極限”(~1 mm),可實現50 mm的深層活體內組織成像。
光聲效應最早於1880年由貝爾發現。貝爾發現用周期性的光照射一個吸收體時, 該物質吸收光會產生聲信號, 這種聲信號的頻率與入射光的調製頻率相同, 而且聲信號的強度隨樣品吸收光的增加而增加。由於當時沒有強的光源和靈敏的探測器, 貝爾的發現沒有得到應用。在此之後的近80年,關於光聲效應的研究與應用幾乎沒有進展。20世紀60年代以後,由於微信號檢測技術的發展,高靈敏微音器和壓電陶瓷傳聲器的出現,以及強光源(激光器、氙燈等)的問世,光聲效應及其應用的研究又重新活躍起來。L B Kruezer將光聲效應用於氣體成分的檢測,關於光聲效應的研究才重新受到人們的重視。基於光聲效應發展起來的光譜技術也隨之發展起來並且應用於測定傳統光譜法難以測定的光散射強或不透明的樣品,如凝膠,溶膠,粉末,生物試樣等,廣泛應用於物理、化學、生物醫學和環境保護等領域。在此之後,光聲效應陸續被應用於各個領域中,但進展仍相當遲緩。直到90年代後期,基於光聲效應的光聲成像技術才迅速發展起來並被廣泛應用於生物醫學領域。
光聲信號產生的基本原理是:當用短脈衝激光照射吸收體時,吸收體中的分子吸收光子后,當滿足一定的條件時,吸收體分子的電子從低能級躍遷到高能級而處於激發態,而處於激發態的電子極不穩定,當電子從高能級向低能級躍遷時,會以光或熱量的形式釋放能量。在光聲成像應用中通常會選擇合適波長的激光作為激發源,使吸收的光子的能量轉化為熱能的效率最大,通常從光能轉化為熱能的效率可達到90%以上。釋放的熱量導致吸收體局部溫度升高,溫度升高后導致熱膨脹而產生壓力波,這就是光聲信號。因此,光聲信號的產生過程就是“光能”-“熱能”-“機械能”的轉化過程。
光聲成像
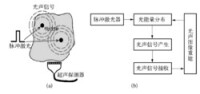
光聲成像過程可以分為三個部分:信號的產生、信號的接收和信號處理及圖像重建(見圖1)。由於脈衝激光器具有光聲轉換效率高的優點,因此通常被作為光聲成像研究中產生信號的激勵源。脈衝激光器發出的激光束照射在待研究組織樣品上,由於組織樣品的吸收效應,在樣品內部形成了與組織光學參數相關的能量沉積分佈。由於激光脈寬很窄(ns)吸收的能量不能在短時間內釋放,導致瞬間溫度變化,從而通過熱彈機制轉化為熱膨脹。周期性熱流使周圍的介質熱脹冷縮而激發超聲波,由於這種超聲波信號的特殊產生機理,為了區別於其它的超聲信號,通常稱為光聲信號。利用超聲探測器接收光聲信號並對採集到的信號進行適當地處理和採用相應的圖像重建演演算法,就能夠得到樣品內部光能量沉積的分佈。當保證入射光的均勻性的前提下,光聲重建圖像與吸收分佈具有一一對應的關係。
光聲成像將光學成像和超聲成像的優點結合起來,一方面,在光聲成像中用來重建圖像的信號是超聲信號,生理組織對超聲信號的散射要比光信號低2到3個數量級,因此它可以提供較深的成像深度和較高的空間解析度;另一方面,光聲成像根據不同組織對可見光、近紅外光或無線電頻率(Radio frequency)電磁波的選擇性吸收,利用特定波長的激光脈衝對組織進行照射,並間接地對脈衝能量在生理組織中的吸收分佈進行成像,成像的是被“吸收”的光能,這在純光學成像中是無法做到的,因此相比純超聲成像,光聲圖像中不同組織間的光學對比度較高。光聲成像與傳統醫學影像技術相比具有如下特點:
第一,由於激光的窄線寬,利用生物組織的高光譜選擇性吸收差異,光聲成像能夠實現高特異性光譜組織的選擇激發, 不僅可以反映組織結構特徵,更能夠實現功能成像,開創了一種有別於傳統醫學影像技術的新成像方法與技術手段。
第二,光聲成像結合了光學成像和聲學成像的優點。一方面,比純光學成像穿透更深(可突破激光共聚焦顯微成像(LCSM)、雙光子激發顯微成像(TPEF)、光學弱相干層析成像(OCT)等高解析度光學成像深度“軟”極限(~1mm);另一方面,比傳統的MRI以及PET成像擁有更高的解析度;其圖像解析度可達到亞微米、微米量級,可實現高解析度的分子成像。
第三,光聲成像是一種非侵入式成像技術,這對於在體成像非常重要。由於使用的激光功率密度低於生物組織損傷閾值,組織中產生的超聲場強度遠遠低於組織的損傷閾值,所以光聲成像是一種非入侵、非電離的無損傷的成像技術。
第四,隨著光聲成像系統的一體化、小型化,該成像系統比傳統的MRI以及PET腦功能成像系統價格更便宜,使用更便捷,利於普及和推廣。
因此,無損光聲成像作為一種新興的醫學影像技術,能夠在一定的深度下獲得足夠高的解析度和圖像對比度,圖像傳遞的信息量大,可以提供形態及功能信息,在生物醫學應用領域具有廣闊的應用前景。
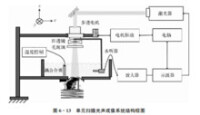
圖2 光聲斷層成像系統構架圖

光聲成像
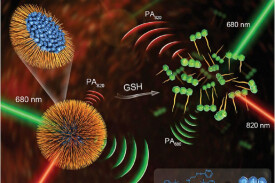
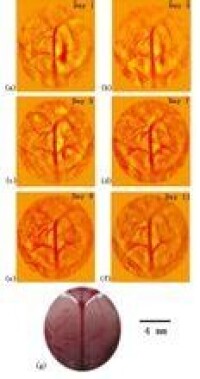
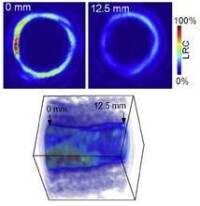
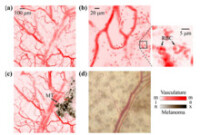
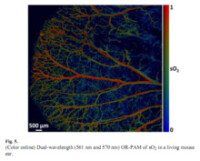
目前光聲成像的主要研究分支有光聲斷層成像(Photoacoustic tomography, PAT,見圖2)、光聲顯微成像(Photoacoustic microscopy, PAM,見圖3)、光聲內窺成像(Intravascular photoacoustic imaging, IVPAI)。光聲斷層成像清晰地探測到活體小鼠腦血管分佈(見圖4),根據血容量、血流、血氧等參數反映了腦功能信息。光聲成像技術將為腦功能研究提供新的技術手段。基於光聲成像反映光吸收的特性,研究者發展了多波長光聲成像技術並且應用於腫瘤成像,獲得高解析度的腫瘤新生血管的形態學信息、由血氧飽和度反映的腫瘤代謝信息。光聲成像技術為腫瘤的早期診斷與治療監控提供了強大的技術支持。多波長光聲成像在檢測活體深層熒光蛋白表達以及基因活性方面取得令人振奮的效果。多波長內窺光聲成像針對動脈粥樣硬化斑塊進行檢測,通過光譜解析獲得了動脈粥樣硬化斑塊組份信息(見圖5),為光聲內窺成像應用於心腦血管疾病檢測奠定了實驗基礎。隨著光聲顯微鏡的出現,光聲成像發展到了一個新的階段。光聲顯微鏡將橫向解析度提高了一個數量級達到了45µm。利用光聲顯微成像技術不僅可以獲得高解析度黑色素瘤的實體和周圍的微血管的形態結構圖像(見圖6),還可以得到活體動物的血氧飽和度信息(見圖7)。亞波長光學解析度光聲顯微鏡的出現將光聲成像技術的解析度提高到前所未有的高度,達到了221 nm。光學解析度的光聲顯微鏡(OR-PAM)可以輕而易舉地對黑色素瘤細胞和血紅細胞進行單細胞成像。光聲納米探針的發展為光聲成像增添了活力。基於外源光聲納米探針,研究者們發展了光聲分子成像和光聲治療。光聲分子成像實現了在磁環境中對在血液中循環的腫瘤細胞進行探測以確定腫瘤細胞是否轉移,最後發展成了光聲流式細胞儀。
光聲成像
光聲成像
光聲成像
光聲成像
作為新一代的無損醫學成像技術,光聲成像可以無標記地對單個細胞成像、可以對血管形態的高分辨成像、對不同組織的成份進行解析和對血液參數高特異性的功能檢測。光聲成像實現了從細胞到組織結構的多尺度示蹤及功能成像。光聲成像可以用於研究動物體腦功能、腫瘤細胞轉移和腫瘤形態結構,生理、病理特徵,血流異常、藥物代謝功能、深層熒光蛋白表達、基因活性等方面的內容,為生物醫學應用領域提供了重要研究及監測手段,具有良好的發展前景和廣泛的生物醫學應用潛力。預期光聲成像技術將會引起基礎生命科學以及臨床醫學影像領域的變革。
光聲成像能夠有效的進行生物組織結構和功能成像,為研究生物組織的形態結構,生理特徵,病理特徵,代謝功能等提供了重要的手段,特別適合於癌症的早期檢測和治療監控。目前的光聲成像技術多用於科研,光聲成像已經成為一個快速發展的研究領域,現今光聲技術正由微觀實驗室階段逐步走向宏觀臨床實踐階段。
光聲成像目前可用於:
2. 藥物代謝研究:利用分子影像學技術,實時監測標記藥物在動物體內的運動情況,從而判斷該藥物是否能夠準確到達靶區和代謝途徑,以及治療效果評測。
3.腫瘤研究:直接快速地測量和跟蹤各種癌症模型中腫瘤的生長和轉移,及伴隨的血管生成過程,如肝癌模型、骨轉移模型等;並可對腫瘤的生長和轉移(或癌症治療)中血紅蛋白濃度和血氧飽和度的變化、血管生成抑制效果等信息進行實時成像與分析。
4. 基因表達:在活體動物體內觀察和研究基因的表達, 細胞或組織特異性, 及其治療反應。
5.幹細胞及免疫研究:標記細胞,實時觀測動物體內幹細胞治療效果,並用於抗腫瘤免疫治療。
6.細菌與病毒研究:通過對細菌與病毒進行特異性熒光探針標記,研究侵染過程等。轉基因動物模型:如大小鼠的疾病模型。
7.疾病早期診斷:用分子影像學可對分子水平的病變進行檢測,遭遇以病理改變為評判基礎疾病診斷,實現疾病早期診斷。
及其它應用領域:如分子光學、腦科學研究等。
1. S. H. Yang, D. Xing, Y. Q. Lao, D. W. Yang, L. M. Zeng, L. Z. Xiang and W. R. Chen, Noninvasive monitoring of traumatic brain injury and post-traumatic rehabilitation with laser-induced photoacoustic imaging, Appl. Phys. Lett. 90, 243902 (2007).
J. Zhang,S. H. Yang, X. R. Ji, Q. Zhou and D. Xing, Characterization of Lipid-Rich Aortic Plaques by Intravascular Photoacoustic Tomography: Ex Vivo and In Vivo Validation in a Rabbit Atherosclerosis Model with Histologic Correlation, J Am Col Cardiol, 64(4), 385-390, (2014).
Y. Zhao, S. H. Yang, C. G. Chen, and D. Xing, Simultaneous optical absorption and viscoelasticity imaging based on photoacoustic lock-in measurement, Opt. Lett.,39(9), 2565, (2014).
H. Qin, T. Zhou, S. H. Yang, Q. Chen and D. Xing, GdIII-gold nanorods for MRI and PAI dual-modality detection of macrophages in atherosclerotic inflammation, Nanomedicine,8(10), 1611-1624, (2013).
J. P. Zhong, S. H. Yang, X. H. Zheng, T. Zhou and D. Xing, In vivo photoacoustic therapy with cancer-targeted indocyanine green-containing nanoparticles, Nanomedicine, 8(6), 903-919, (2013).
Z. J. Chen, S. H. Yang and D. Xing, In vivo detection of hemoglobin oxygen saturation andcarboxyhemoglobin saturationwith multiwavelength photoacoustic microscopy, Opt. Lett., 37(16), 3414-3416, (2012).
7. S. H. Yang, F. Ye and D. Xing, Intracellular label-free gold nanorods imaging with photoacoustic microscopy, Opt. Express., 20(9), 10370, (2012).
G. D. Gao, S. H. Yang, D. Xing, Viscoelasticity imaging of biological tissues withphase-resolved photoacoustic measurement,Opt. Lett.,36, 3341-3343, (2011).
F. Ye, S. H. Yang and D. Xing, Three-dimensional photoacoustic imaging system in line confocal modefor breast cancer detection, Appl. Phys. Lett., 97(21), 213702, (2010).
S. H. Yang, D. Xing, Q. Zhou, L. Z. Xiang and Y. Q. Lao, Functional imaging of cerebrovascular activities in small animalsusing high-resolution photoacoustic tomography, Med. Phys., 34(8), 3294-3301, (2007).
H. Wang, D. Xing and L. Xiang, Photoacoustic imaging using an ultrasonic Fresnel zone plate transducer, Appl. Phys. 41 (2008).
Y. Yuan, S. H. Yang and D. Xing, Optical-resolution photoacoustic microscopy based on two dimensional scanning galvanometer, Appl. Phys. Lett. 100, 0237021-3 (2012).
B. B. Li, H. Qin, S. H. Yang and D. Xing, In vivo fast variable focus photoacoustic microscopy using an electrically tunable lens, Opt. Express., 22(17), 20130, (2014).
X. D. Wang, Y. J. Pang, G. Ku et al. Noninvasive laser-induced photoacoustic tomography for structural and functional in vivo imaging of the brain, Nature Biotechnology, 21,803-806, (2003).
H. F. Zhang, K. Maslov, G. Stoica et al, Functional photoacoustic microscopy for high-resolution and noninvasive in vivo imaging, Nature Biotechnol., 24, 848-851, (2006).
Y. G. Zeng, D. Xing, Y. Wang et al, Photoacoustic and ultrasonic co-image with a linear transducer array, Opt. Lett., 29, 1760-1762, (2004).
H. F. Zhang, K. Maslov, L. H. Wang, In vivo imaging of subcutaneous structures using functional photoacoustic microscopy, Nat. Protoc., 2, 797-804, (2007).
G. Ku, L. V. Wang, Deeply penetrating photoacoustic tomography in biological tissues enhanced with an optical contrast agent, Opt. Lett., 30, 507-509, (2005).