α螺旋
α螺旋
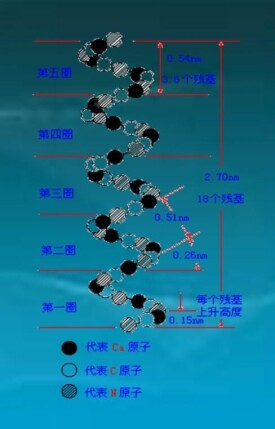
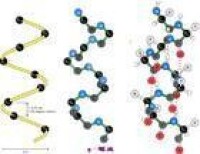
α-螺旋(α-helix)是蛋白質二級結構的主要形式之一。指多肽鏈主鏈圍繞中心軸呈有規律的螺旋式上升,每3.6個氨基酸殘基螺旋上升一圈,向上平移0.54nm,故螺距為0.54nm,兩個氨基酸殘基之間的距離為0.15nm。螺旋的方向為右手螺旋。氨基酸側鏈R基團伸向螺旋外側,每個肽鍵的肽鍵的羰基氧和第四個N-H形成氫鍵,氫鍵的方向與螺旋長軸基本平行。由於肽鏈中的全部肽鍵都可形成氫鍵,故α-螺旋十分穩定。
α螺旋
α螺旋是一種最常見的二級結構,最先由Linus Pauling和Robert Corey於1951年提出,其主要內容是:
①肽鏈骨架圍繞一個軸以螺旋的方式伸展;
②螺旋形成是自發的,肽鏈骨架上由n位氨基酸殘基上的-C=O與n+4位殘基上的-NH之間形成的氫鍵起著穩定的作用;被氫鍵封閉的環含有13個原子,因此α螺旋也稱為3.6/13螺旋;
③每隔3.6個殘基,螺旋上升一圈;每一個氨基酸殘基環繞螺旋軸100°,螺距為0.54nm,即每個氨基酸殘基沿軸上升0.15nm;螺旋的半徑是0.23nm;Φ角和Ψ角分別為-57°和-48°;
④α螺旋有左手和右手之分,但蛋白質中的α螺旋主要是右手螺旋;
⑤氨基酸殘基的R基團位於螺旋的外側,並不參與螺旋的形成,但其大小、形狀和帶電狀態卻能影響螺旋的形成和穩定。
α-螺旋在DNA結合基序(DNA binding motifs)中有非常重要的作用,比如在鋅指結構,亮氨酸拉鏈,螺旋-轉角-螺旋等基序中都含有α-螺旋。這是因為α-螺旋的直徑為1.2nm,正好和B-DNA大溝的直徑相等,所以能夠和B型DNA緊密結合。
α-螺旋靠氫鍵維持穩定
1. Pro(及Hpro)使α-螺旋中斷,產生“結節”。Pro的α-碳原子參與吡咯環的形成,使α-碳原子—N鍵不能旋轉,Gly繞α-碳原子的自由度更大,所以大多α-螺旋起始或中止於Gly,還有Tyr和Ser等。
2.側鏈較大的氨基酸相鄰時影響生成兩個“α-碳上分支”(α-碳原子上除了H,還有兩個其他基團接在上面,如Thr,Ile(ile),Val等)
3.帶相同電荷的氨基酸相鄰,使α-螺旋趨於解體