實際氣體狀態方程
實際氣體狀態方程
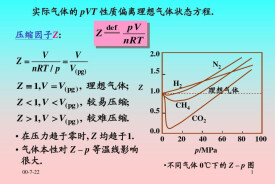
實際氣體狀態方程(actual gases, equation of state for)是指一定量實際氣體達到平衡態時其狀態參量之間函數關係的數學表示。理想氣體完全忽略氣體分子間的相互作用,不能解釋分子力起重要作用的氣液相變和 節流等現象。理想氣體狀態方程只對高溫低密度的氣體才近似成立,對物質狀態的大部分區域都不適用。
紀,.伯努提剛球模型,考慮積影響,狀態方程改為 p( V- b) = RT的形式。1847年,H.勒尼奧做了大量實驗,發現除氫氣以外,沒有一種氣體嚴格遵守玻意耳定律(見理想氣體狀態方程)。以後隨著實驗精度的提高,人們發現實際氣體有著與理想氣體不同的性質,如體積變化時內能也發生變化、有相變的臨界溫度等(見相和相變)。實際氣體的分子具有分子力,即使在沒有碰撞的時刻,分子之間也有相互作用,因而其狀態的變化關係偏離理想氣體狀態方程。只是在低壓強下,理想氣體狀態方程才較好地反映了實際氣體的性質,隨著氣體密度的增加,兩者的偏離越來越大。1873年荷蘭物理學家J.范德瓦耳斯假設氣體分子是有相互吸引力的剛球,作用力範圍的半徑大於分子的半徑,氣體分子在容器內部與在容器壁處受到的力不同。范德瓦耳斯方程能較好地給出高壓強下實際氣體狀態變化的關係,而且推廣后可以近似地應用到液體狀態。它是許多近似方程中最簡單和使用最方便的一個。
獲反映際質狀態程,必須考慮際基征,狀態程修。①際質點,佔有一定的體積,當兩個分子足夠靠近時將產生強烈的排斥力;②實際氣體分子間的距離大於平衡距離,小於有效作用半徑時,分子間互相吸引。范德瓦耳斯首先於1873年應用蘇則朗勢[剛球勢加上隨距離成(- r )關係增加的引力勢]成功地修正理想氣體狀態方程,得到了溫度、壓強和摩爾體積分別為 T, p和 V的1摩爾范德瓦耳斯氣體(簡稱范氏氣體)狀態方程:
( p+ a/ v )( v- b)= RT
式中的 a和 b是分別考慮了范氏氣體分子之間有引力作用和分子佔有一定體積而引進的范氏修正量。表1中列出了一些氣體的范德瓦耳斯修正量 a和 b的實驗值。由於在得到范氏狀態方程時,並未對范氏氣體的宏觀條件如溫度和密度等作出限制,因此它能相當好地解釋氣液相變,並能對高密度氣體以致液體的性質作出定性的解釋。
表1 一些氣體的范德瓦耳斯修正量a和b的實驗值
| 氣體 | a(J·m·mol) | b(m/mol) |
| 氧 | 0.138 | 3.19×10 |
| 氮 | 0.137 | 3.86×10 |
| 氫 | 0.0248 | 2.66×10 |
| 氦 | 0.00324 | 2.34×10 |
| 氬 | 0.137 | 3.23×10 |
| 二氧化碳 | 0.365 | 4.28×10 |
| 氨 | 0.424 | 3.73×10 |
| 水蒸氣 | 0.555 | 3.06×10 |
另一個得到廣泛應用的非理想氣體狀態方程是由開默林·昂內斯在20世紀初提出的一個按氣體的摩爾體積 V的負冪次或其壓強 p的正冪次展開的級數形式的昂內斯狀態方程(也稱為位力展開):
pV= A(1+ B/ V+ C/ V + D/ V +···)
或 pV= A′(1+ B′ p+ C′ p + D′ p +···)
式中的 A、 B、 C、 D···或 A′、 B′、 C′、 D′···分別稱為第一、第二、第三、第四位力係數,它們的數值只與溫度和氣體的性質有關。當一定量氣體的摩爾體積 V趨於無窮大或其壓強 p趨於零時,應得到玻意耳定律,故第一位力係數 A= A′= RT只是溫度的函數,與氣體性質無關。表2給出了溫度為80—273K和壓強為0—200標準大氣壓時氮的位力係數的數值。由表可見,溫度越低,位力係數的數值越大,氣體偏離理想氣體越遠。
表2 氮的位力係數
| T/K | B (10m/mol) | C (10m/mol) | D (10m/mol) | E (10m/mol) | F (10m/mol) |
| 80 | -250.80 | 210 | -2000 | ||
| 90 | -200.50 | 135 | -1000 | ||
| 100 | -162.10 | 85 | -600 | ||
| 110 | -131.80 | 65 | -200 | ||
| 120 | -114.62 | 48 | -27 | ||
| 150 | -71.16 | 22 | 13 | -12.3 | 4.1 |
| 200 | -34.33 | 12 | 14 | -11.8 | 3.6 |
| 273 | -9.50 | 8.2 | 16 | -7.5 | -1.6 |
20世紀40年代,J.邁爾應用統計物理學中的集團展開法從理論上證明了位力展開,並得到了各級位力係數與物質分子力之間關係的數學式。為位力展開的確立提供了清晰的物理圖像,並使從理論上計算位力係數成為可能。