β螺旋
β螺旋
β螺旋(beta helix)是一種蛋白質的超二級結構,由平行的β摺疊構成,形成一種螺旋的形態。β螺旋是一種螺旋狀的形態,但與二級結構α螺旋差別較大。β螺旋的結構通過氫鍵和蛋白質相互作用來維持穩定。有時也結合金屬離子。左旋與右旋的β螺旋均以被證明。
第一個被發現的β螺旋結構是在酶的果膠酸裂解酶中,其中包含一七轉螺旋,達到34Å(3.4 nm)長。P22噬菌體的tailspike蛋白,擁有一個13圈的螺旋,由其構成的同源三聚體達到了200Å(20 nm)的長度。它的內部密集,無中心孔,包含了疏水殘基和通過鹽橋中和的帶電殘基。
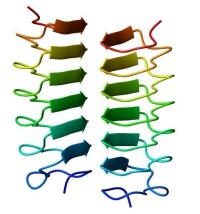
右手β螺旋的甲蟲黃粉蟲抗凍蛋白二聚體
β-螺旋可以有效地相互聯繫,無論是面對面(交配的三稜柱面)或端到端(形成氫鍵)的形態。因此,β螺旋可以類似捲曲螺旋段,作為“標籤”誘導其他蛋白質關聯。
三股β螺旋形成一個扭曲的三角稜柱形,每個平面依靠氫鍵。三股摺疊片中的一股可以使其他兩股的重複結構的圖案可以出現“彎曲”,即以雙股螺旋的形態面對對方。在摺疊片中,三個環中的兩個可以是任意長度的,甚至可以包含其他結構域;第三個環則限制在兩個殘基的大小。科學家發現了一個共同特點,有一段六肽大小的重複序列在左和右手螺旋均被發現。相比較雙股的配對物,發現的三股螺旋要長許多。
在已發現的五肽重複螺旋中,已經發現具有一個四邊形的重複結構。
