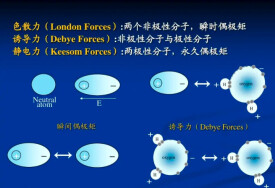
色散力
1930年發現的吸引力
非極性分子相互靠攏時,它們的瞬時偶極矩之間會產生很弱的吸引力,這種吸引力稱為色散力。色散力存在於一切分子之間。任何一個分子,都存在著瞬間偶極,這種瞬間偶極也會誘導鄰近分子產生瞬間偶極,於是兩個分子可以靠瞬間偶極相互吸引在一起。這種瞬間偶極產生的作用力稱為色散力(dispersion force)。色散力是倫敦(London)於1930年根據近代量子力學方法證明的,由於從量子力學導出的理論公式與光色散公式相似,因此把這種作用稱為色散力,又叫做倫敦力。
任何一個分子,由於電子的不斷運動和原子核的不斷振動,常發生電子雲和原子核之間的瞬時相對位移,從而產生瞬時偶極。分子靠瞬時偶極而相互吸引,這種力稱為色散力。色散力主要與分子的變形性有關,分子的變形性越大,色散力越強。它存在於一切分子之間。
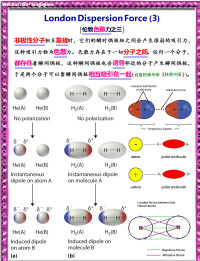
色散力
由於分子中電子和原子核不停地運動,非極性分子的電子云的分佈呈現有漲有落的狀態,從而使它與原子核之間出現瞬時相對位移,產生了瞬時偶極,分子也因而發生變形。分子中電子數愈多、原子數愈多、原子半徑愈大,分子愈易變形。瞬時偶極可使其相鄰的另一非極性分子產生瞬時誘導偶極,且兩個瞬時偶極總採取異極相鄰狀態,這種隨時產生的分子瞬時偶極間的作用力為色散力(因其作用能表達式與光的色散公式相似而得名)。雖然瞬時偶極存在暫短,但異極相鄰狀態卻此起彼伏,不斷重複,因此分子間始終存在著色散力。無疑,色散力不僅存在於非極性分子間,也存在於極性分子間以及極性與非極性分子間。
色散力存在於一切分子之間。色散力與分子的變形性有關,變形性越強越易被極化,色散力也越強。稀有氣體分子間並不生成化學鍵,但當它們相互接近時,可以液化並放出能量,就是色散力存在的證明。
量子力學計算表明,色散力與分子變形性有關,變形性越大,色散力越強。由於各種分子均有瞬間偶極,所以色散力存在於極性分子和極性分子、極性分子和非極性分子以及非極性分子和非極性分子之間。而且在一般情況下,色散力是主要的分子間力。只有極性相當強的分子,取向力才顯得重要。
色散力、誘導力和取向力統稱為范德華力(分子間作用力)。它是在人們研究實際氣體對理想氣體的偏離時提出來的。由於隨著分子間距離的增大而迅速減小,所以它是一種近程力,表現為分子間近距離的吸引力,作用範圍只有幾個皮米。其作用能的大小從幾到幾十焦耳每摩爾,比化學鍵的鍵能小1~2個數量級。與共價鍵不同,分子間力沒有方向性和飽和性。分子間力包括三種作用力,由於相互作用的分子不同,這三種力所佔的比例也不同,但色散力通常是最主要的。
分子間力有以下特點:①分子間力的大小與分子間距離的6次方成反比。因此分子稍遠離時,分子間力驟然減弱。它們的作用距離大約在300~500pm範圍內。分子間既保持一定接觸距離又“無”電子云的重疊時,相鄰兩分子中相互接觸的那兩個原子的核間距之半稱原子的范德華半徑。氯原子的范德華半徑為180pm,比其共價半徑99pm大得多。②分子間力沒有方向性和飽和性。③分子間力作用能一般在2~20KJ·mol,比化學鍵能(100~600kJ·mol)小約1~2數量級。