濃差電池
電極兩極存在濃度差的電池
一般所說的原電池在電池工作時都有某種化學變化發生,因而被稱為化學電池。還有一類原電池,它雖然也經歷了氧化還原過程,但電池的總反應中並沒有反映出這種變化,其凈的作用僅僅是一種物質從高濃度狀態向低濃度狀態的轉移,這一類電池被稱為濃差電池。
濃差電池是指電池內物質變化僅是由一物質由高濃度變成低濃度且伴隨著過程吉布斯自由能變化轉變成電能的一類電池。與自發擴散作用不同,在濃差電池中物質的轉移是間接地通過電極反應以實現的,故其吉布斯自由能變可轉變為電功
濃差電池分"單液濃差電池"(電極濃差電池)和"雙液濃差電池"(溶液濃差電池)兩大類。而雙液濃差電池又分為"有液接電勢濃差電池"和"消除液接電勢濃差電池"。但不管是何種濃差電池,其電池的標準電動勢均為零。這是由於,而濃差電池所選用的電極的標準電極電勢是一樣的,即 ,所以有E(電池)為0V 。
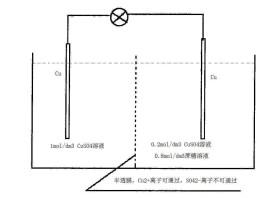
濃差電池的一種。它的兩個電極相同,但溶液中電解質的濃度不同。例如,以兩個氯化銀電極分別插在濃度不 同的鹽酸溶液中組成的電池Ag,,Ag,由於在不同活度(α)的溶液接觸界面上存在著因離 子遷移率不同而產生的液接電位,電池為 不可逆,其電動勢(E)可近似地表達為: ,這種電池又稱“有遷移的溶液濃差電池”。
如果將上述電池用氫氣電極改組為Ag, ,Ag,可得到“無遷移的溶液濃差電池”。
後者如a為鎘在汞齊中的活度,電池的電動勢:
因此,這類電池電動勢的大小僅決定於兩極的濃度(或壓力)差別,與溶液的濃度無關。
濃差電池的兩個溶液界面上存在液接電勢,採用鹽橋后可基本消除,但從熱力學嚴格意義上講並不理想。如果不用鹽橋而是用一個離子膜,即離子可以通過而保持界面不變,則液接電勢對電池電動勢的影響就要考慮 。液體接界電勢來源於 離子擴散速度的差異,這一電勢有時可達30 mV,這對於EMF的測定是不能忽視的。
如電池反應:當1mol元電荷可逆輸出,將有和分別向右、向左遷移過界面,即。
遷移過程中的Gibbs自由能變化為:
為液接電勢,對於上述電池,。若遷移數不隨濃度變化,有:
可見液接電池是由於正、負離子遷移數的差別而引起的,t和t相差越大,就越大。