歧化反應
歧化反應
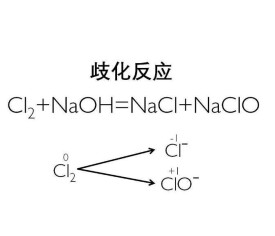
歧化反應,英文(disproportionation reaction)在反應中,若氧化作用和還原作用發生在同一分子內部處於同一氧化態的元素上,使該元素的原子(或離子)一部分被氧化,另一部分被還原。這種自身的氧化還原反應稱為歧化反應。氯化鈉中氯的化合價下降到-1價;而次氯酸鈉中氯的化合價則上升到+1價。
Cl2 + 2OH− = Cl− + ClO− + H2O
氯氣中氯元素的化合價為0。氯化鈉中氯的化合價下降到-1價;而次氯酸鈉中氯的化合價則上升到+1價。
而氯氣和氫氧化鈉溶液在高溫下反應,生成氯酸鈉、氯化鈉和水。
這兩個反應都是典型的歧化反應。
在KClO3中,一部分氯(Ⅴ)被氧化為氯(Ⅶ)(ClO2);另一部分被還原為氯(I)(Cl)。發生歧化反應的原因是由於該元素具有高低不同的氧化態,可以在適宜的條件下同時向較高和較低的氧化態轉化 在氯酸溶液中Cl一部分被還原為Cl(+4價),一部分被氧化為Cl(+7價)
3HClO3=HClO4+2ClO2+H2O (參考氯酸)
苯甲醛在氫氧化鉀溶液中部分氧化為苯甲酸鉀;部分還原為苯甲醇,也是歧化反應:
2C6H5CHO+KOH─→C6H5COOK+C6H5CH2OH
甲苯在催化劑(一般採用硅鋁催化劑)作用下,使一個甲苯分子中的甲基轉移到另一個甲苯分子上而生成一個苯分子和一個二甲苯分子,這種反應稱作歧化反應。一個甲苯與一個三甲苯也可發生歧化反應(亦稱烷基轉移反應)生成兩個二甲苯分子。工業上用這個方法生產用途廣泛的苯和二甲苯。
再如過氧化鈉吸收二氧化碳生成碳酸鈉和氧氣
2Na2O2+2CO2=2Na2CO3+O2
Na2O2的氧元素化合價為-1,而Na2CO3的氧元素為-2價,O2中氧元素化合價為0 ,因此過氧化鈉中的氧元素化合價既有升高的,也有降低的,這樣的反應就叫歧化反應。
沒有α-氫原子的醛在強鹼(濃)的作用下發生分子間氧化還原反應生成羧酸和醇,又叫康尼查羅反應
2HCHO + NaOH → CH3OH + HCOONa
2C(CH3)3-CHO + NaOH → C(CH3)3-CH2OH + C(CH3)3-COONa
兩種不同的無α-氫的醛發生交叉康尼查羅反應。一分子醛被氧化成羧酸,另一分子醛被還原成醇。理論上為4種產物。
6判斷歧化反應能否發生
運用元素電勢圖來判斷歧化反應能否發生。如:
ClOˉ→(0.4)Cl2(1.36)←Clˉ
左邊0.4小於右邊1.36的電勢故歧化反應可以發生
E左小於E右即可發生