孤立體系
孤立體系
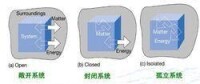
孤立體系是指:系統與環境之間既無物質交換,又無能量交換,故稱為孤立體系。有時候把封閉體系和體系影響所及的環境一起作為孤立體系來考慮。
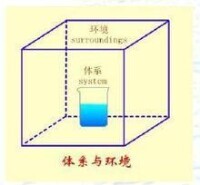
體系與環境
體系:在科學研究時必須先確定研究對象,把一部分物質與其餘分開,這種分離可以是實際的,也可以是想像的。這種被劃定的研究對象稱為體系。也可以稱為物系或系統。
環境:與體系密切相關,有相互作用或影響所能及的部分稱為環境。
孤立體系
孤立體系
任何能量或質量都不能進入或者離開一個孤立系統,只能在系統內移動。除了把整個宇宙視為一體之外,孤立系統並不存在於現實之中。但是,在一定次數內,有些真實系統的行為近乎於孤立系統。因而,孤立系統的概念可以作為真實情況的一個近似模型。在建立以數學模型描述一些自然現象時,孤立系統是個可被接受的模型。孤立系統的能量守恆,粒子數也同時守恆。
可被近似於孤立系統的模型包括:
2.氫原子內的質子以及電子(在某情況下氫原子會被電磁輻射激發)
3.由堅固的不導熱壁包裹的氣體或者液體
在熱力學體系中,通常把溫度、壓力、體積、密度等宏觀物理量稱為體系的性質。按其特徵可將體系的性質分為兩種類型:
1)廣度性質(extensive property): 量值與體系中物質 的數量成正比,所以又稱容量性質。比如物質的體積、質量、熱容量以及隨後將介紹的熱力學能和焓等都是廣度性質。廣度性質具有加和性。
2)強度性質(intensive property): 量值取決於體系的 自身特性,與體系中物質的數量無關,不具有加和性。比如溫度、壓力、濃度、密度、粘度等即都是體系的強度性質。強度性質不具有加和性。
(1)體系的狀態確定,體系的各種性質即所有的狀態函數也都確定,反之亦然。
(2)當體系的狀態發生變化,體系的狀態函數也變化,但不一定所有的狀態函數都變化,如定溫、定壓過程。
(3)反過來,當體系有一個狀態函數發生變化,體系的狀態一定發生變化。
其他兩種熱力學常用的假象體系:
敞開系統:系統與環境之間既有物質交換,又有能量交換;經典熱力學不研究敞開系統;
封閉系統:系統與環境之間無物質交換,但有能量交換;經典熱力學最為廣泛研究的系統;
