sp2雜化
sp2雜化
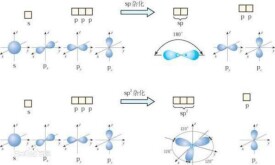
sp2雜化是由同一層的一個s軌道與3個p軌道中的兩個形成,多用於形成兩個單鍵與一個雙鍵,即形成有機物中的烯烴,醛,酮,醯等。sp2雜化一般發生在分子形成過程中。三個sp2雜化軌道的對稱軸在同一條平面上,兩兩之間的夾角皆為120°。ℏ自旋的電子,s軌道即一個圓形的電子云,而p軌道則為紡錘型軌道。乙烯是最普遍的sp2雜化形式,碳原子在形成乙烯分子時,每個碳原子的2s軌道與兩個2p軌道發生雜化,稱為sp2雜化,其形狀與sp3雜化軌道相似,在空間以碳原子為中心指向平面三角形的三個頂點。
(英語: hybridization)是指一個原子同一電子層內由一個ns軌道和兩個np軌道發生雜化的過程。原子發生雜化后,上述ns軌道和np軌道便會轉化成為三個等價的原子軌道,稱為“雜化軌道”。三個雜化軌道的對稱軸在同一條平面上,兩兩之間的夾角皆為。雜化一般發生在分子形成過程中。雜化發生前,原子最外層s軌道中的一個電子被激發至p軌道,使將要發生雜化的原子進入激發態;之後,該層的s軌道與三個p軌道中的任意兩個發生雜化。此過程中,能量相近的s軌道和p軌道發生疊加,不同類型的原子軌道重新分配能量並調整方向。
雜化軌道無孤對電子時含s和p的成分。一個s軌道和兩個p軌道雜化,形成3個完全相同的雜化軌道。其3個軌道間夾角為,呈平面正三角形。
軌道是根據泡利不相容原理,洪特原則以及能量最低原則進行排布,每一個軌道中都含有兩個有ℏ自旋的電子,s軌道即一個圓形的電子云,而p軌道則為紡錘型軌道。雜化后,雜化軌道與其他軌道形成一個"頭碰頭“的鍵,而剩餘的p軌道如果不是空軌的情況下,會與其他p軌道”肩並肩“形成p—p鍵或一個p—p大鍵。其鍵的本質是兩軌道相交部分形成一個密集電子云。
未雜化的一個2p軌道則垂直與雜化軌道的平面。三個雜化軌道與未雜化的一個2p軌道各有一個未成對電子。兩個碳原子分別以一個雜化軌道互相重疊形成
鍵,兩個碳原子的另外四個雜化軌道分別與氫原子結合。所有碳原子和氫原子在同一平面上,而兩個碳原子未雜化的2p軌道垂直於這個平面。它們互相平行,彼此肩並肩重疊形成鍵。所以,在乙烯分子中是以雙鍵結合,雙鍵由一個鍵與一個鍵構成。
苯環中的每個碳原子採用雜化方式,每個碳原子都有一未參加雜化的p軌道。由於苯是平面分子,因此6個未參加雜化的p軌道互相平行。所以苯分子中有型大鍵。
實驗測知BF3的4個原子在同一平面上,鍵角∠FBF等於120°。B原子的外層電子構型是,成鍵時1個2s電子激發到1個空的2p軌道上,與此同時,1個s軌道和2個p軌道“混合”起來成為3個雜化軌道,分別與3個F原子成鍵。