弱電解質
水溶液中不完全發生電離的電解質
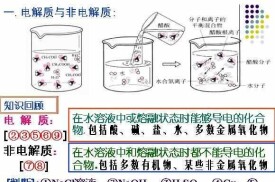
概念:弱電解質(weak electrolyte)是在水溶液中或熔融狀態下不完全(少部分)發生電離的電解質。
弱電解質導電的性質與溶液濃度和溫度有關,與物質的溶解度無關。
弱電解質在水溶液中既有分子存在又有離子存在。
水是極弱電解質。
電解質(英語:electrolyte)是指在水溶液或熔融狀態可以產生自由離子而導電的化合物。通常指在溶液中導電的物質,但熔融態及固態下導電的電解質也存在。這包括大多數可溶性鹽、酸和鹼。一些氣體,例如氯化氫,在高溫或低壓的條件下也可以作為電解質。電解質通常分為強電解質和弱電解質。
自1881年起,斯凡特·奧古斯特·阿倫尼烏斯開始在埃里克·艾德隆德的指導下進行電解質的相關研究。1884年,他向烏普薩拉大學提交了一篇長約150頁的博士畢業論文,首次提出了“固體結晶鹽在溶解時會分解成成對的帶電粒子”這一觀點,並通過離子的概念解釋了電解質溶液的導電機理。他因此獲得了1903年的諾貝爾化學獎。
根據阿倫尼烏斯的觀點,鹽在形成溶液時會分解成一種帶電粒子,這種粒子在很多年前便被麥可·法拉第命名為“離子”。麥可·法拉第認為離子是在電解時產生的,但阿倫尼烏斯認為即使在沒有電流的情況下鹽溶液也含有離子,所以溶液中的化學反應便是離子之間的反應。
當鹽被置於溶劑中時往往會形成電解質溶液,在溶劑化時水和各個組分便會由於溶劑和溶質分子之間的熱力學相互作用而離解。
物質還可能與水反應併產生離子。例如,二氧化碳氣體在水中溶解後會得到含有水合氫離子、碳酸根離子和碳酸氫根離子的溶液。
弱酸
HS、HCO、CHCOOH、HF(氫氟酸)、HCN、HClO(次氯酸)等。HF酸是具有強極性共價鍵的弱電解質。HPO、HSO從其酸性強弱看屬於中強酸,但仍屬於弱電解質。弱電解質必須是化合物,單質不是電解質。
弱鹼
一水合氨(並非氨水)兩性氫氧化物:氫氧化鋁,氫氧化鋅。
某些鹽
如HgCl、Pb(Ac)、HgBr、CdI等
水
是由強極性鍵構成的極弱的電解質。
• 化合物
• 非電解質
• 離子化合物
• 共價化合物
• 高分子電解質