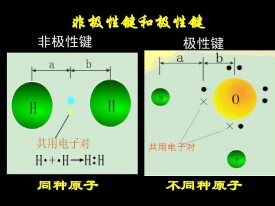
非極性鍵
成鍵的原子都不顯電性的共價鍵
在分子中,同種原子形成共價鍵,兩個原子吸引電子的能力相同,共用電子對不偏向任何一個原子,因此成鍵的原子都不顯電性。這樣的共價鍵叫做非極性共價鍵,簡稱非極性鍵。
非極性鍵
極性鍵就是 在2個元素之間的化學鍵。一般來說是每個原子提供一個電子來形成一個鍵,而形成極性的原因就是因為2個原子對電子吸引力不同,造成電子對偏向其中一個原子核。就會使偏向的那個原子帶負電。而另外的那個原子就帶正電。
1.同種原子吸引共用電子對的能力相等,成鍵電子對勻稱地分佈在兩核之間,不偏向任何一個原子,成鍵的原子都不顯電性。
2.非極性鍵可存在於單質分子中(如H2中H—H鍵、O2中O=O鍵、N2中N≡N鍵),也可以存在於化合物分子中(如C2H2中的C≡C鍵)。
3.非極性鍵的鍵偶極矩為0。
4.以非極性鍵結合形成的分子都是非極性分子。
5. 存在於非極性分子中的鍵並非都是非極性鍵,如果一個多原子分子在空間結構上的正電荷幾何中心和負電荷幾何中心重合,那麼即使它由極性鍵組成,那麼它也是非極性分子。
6.由非極性鍵結合形成的晶體可以是原子晶體,也可以是混合型晶體或分子晶體。例如,碳單質有三類同素異形體:依靠C—C非極性鍵可以形成正四面體骨架型金剛石(原子晶體)、層型石墨(混合型晶體),也可以形成球型碳分子富勒烯C60(分子晶體)。Q
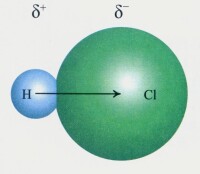
極性鍵是在化合物分子中,不同種原子形成的共價鍵,由於兩個原子吸引電子的能力不同,共用電子對必然偏向吸引電子能力較強的原子一方,因而吸引電子能力較弱的原子一方相對的顯正電性。這樣的共價鍵叫做 極性共價鍵,簡稱 極性鍵。
當電子對兩邊的原子不同時,對電子的吸引力就不同,就會使電子對偏向於電負性大的原子。形成極性。當電子對兩邊的原子相同時,對電子的吸引了就相同,電子就不偏向哪邊原子。形成非極性。
非極性分子的判據:中心原子化合價法和受力分析法
1.中心原子化合價法:
組成為ABn型化合物,若中心原子A的化合價等於族的序數,則該化合物為非極性分子。如:CH4,CCl4,SO3,PCl5
2.受力分析法:
若已知鍵角(或空間結構),可進行受力分析,合力為0者為非極性分子。如:CO2,C2H4,BF3
3.同種原子組成的雙原子分子都是非極性分子。
1、NH3——結構是一個三角錐型的,每個N-H鍵之間的電性不能抵消。就是電子偏向N,而NH3的結構又不是對稱的,所以電性不能抵消,所以就是極性分子。
2、CO2——雖然C-O的電子對有偏向,但是因為CO2的結構是直線型的,所以是對稱的,所以偏向的電子的電性抵消掉了,從而形成非極性分子。