原子晶體
原子晶體
相鄰原子之間通過強烈的共價鍵結合而成的空間網狀結構的晶體叫做原子晶體。在原子晶體這類晶體中,晶格上的質點是原子,而原子間是通過共價鍵結合在一起,這種晶體稱為原子晶體。如金剛石晶體,單質硅,SiO2等均為原子晶體。
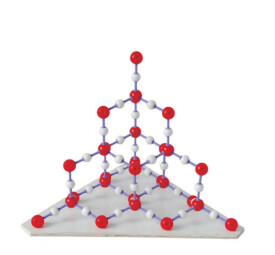
相鄰原子間以共價鍵結合而形成的空間網狀結構的晶體。例如金剛石晶體,是以一個碳原子為中心,通過共價鍵連接4個碳原子,形成正四面體的空間結構,每個碳環有6個碳原子組成,所有的C-C鍵鍵長為1.55×10-10米,鍵角為109°28′,鍵能也都相等,金剛石是典型的原子晶體,熔點高達3550℃,是硬度最大的單質。原子晶體中,組成晶體的微粒是原子,原子間的相互作用是共價鍵,共價鍵結合牢固,原子晶體的熔、沸點高,硬度大,不溶於一般的溶劑,多數原子晶體為絕緣體,有些如硅、鍺等是優良的半導體材料。原子晶體中不存在分子,用化學式表示物質的組成,單質的化學式直接用元素符號表示,兩種以上元素組成的原子晶體,按各原子數目的最簡比寫化學式。常見的原子晶體是周期系第ⅣA族元素的一些單質和某些化合物,例如金剛石、硅晶體、SiO2、SiC等。(但碳元素的另一單質石墨不是原子晶體,石墨晶體是層狀結構,以一個碳原子為中心,通過共價鍵連接3個碳原子,形成網狀六邊形,屬過渡型晶體。)對不同的原子晶體,組成晶體的原子半徑越小,共價鍵的鍵長越短,即共價鍵越牢固,晶體的熔,沸點越高,例如金剛石、碳化硅、硅晶體的熔沸點依次降低。
原子晶體,在這類晶體中,不存在獨立的小分子,而只能把整個晶體看成一個大分子。由於原子之間相互結合的共價鍵非常強,要打斷這些鍵而使晶體熔化必須消耗大量能量,所以原子晶體一般具有較高的熔點,沸點和硬度,在通常情況下不導電,也是熱的不良導體。熔化時也不導電,但半導體硅等可有條件的導電。由中性原子構成的晶體。原子間以共價鍵相聯繫。由於結合較牢,所以原子晶體的硬度較大,熔點較高。例如金剛石是由碳原子構成的原子晶體。石墨是由碳原子構成的另一種原子晶體,每一層碳原子之間結合較牢,但層與層之間為分子間力,結合較弱,因此容易沿層間滑移。硅、硼等單質以及碳化硅、氮化硅等許多化合物晶體都是原子晶體。原子晶體不導電、不易溶於任何溶劑,化學性質十分穩定。例如金剛石,由於碳原子半徑較小,共價鍵的強度很大,要破壞4個共價鍵或扭歪鍵角都需要很大能量,所以金剛石的硬度最大,熔點達3570℃,是所有單質中最高的。又如立方BN的硬度近於金剛石。
原子晶體中,組成晶體的微粒是原子,原子間的相互作用是共價鍵,共價鍵結合牢固,原子晶體的熔、沸點高,硬度大,不溶於一般的溶劑,多數原子晶體為絕緣體,有些如硅、鍺等是優良的半導體材料。原子晶體中不存在分子,用化學式表示物質的組成,單質的化學式直接用元素符號表示,兩種以上元素組成的原子晶體,按各原子數目的最簡比寫化學式。常見的原子晶體是周期系第ⅣA族元素的一些單質和某些化合物,例如金剛石、硅晶體、SiO2、SiC等。(但碳元素的另一單質石墨不是原子晶體,石墨晶體是層狀結構,以一個碳原子為中心,通過共價鍵連接3個碳原子,形成網狀六邊形,屬過渡型晶體。)
規律:原子晶體熔沸點的高低與共價鍵的強弱有關。一般來說,半徑越小形成共價鍵的鍵長越短,鍵能就越大,晶體的熔沸點也就越高。例如:金剛石(C-C)>二氧化硅(Si-O)>碳化硅(Si-C)晶體硅(Si-Si)。
1.原子間形成共價鍵,原子軌道發生重疊。原子軌道重疊程度越大,共價鍵的鍵能越大,兩原子核的平均間距—鍵長越短。
2.一般說來:結構相似的分子,其共價鍵的鍵長越短,共價鍵的鍵能越大,分子越穩定。
3.一般情況下,成鍵電子數越多,鍵長越短,形成的共價鍵越牢固,鍵能越大。在成鍵電子數相同,鍵長相近時,鍵的極性越大,鍵能越大,形成時釋放的能量就越多,反之破壞它消耗的能量也就越多,付出的代價也就越大。

原子晶體
比較金剛石和石英的晶體和晶胞
在這類晶體中,不存在獨立的小分子,而只能把整個晶體看成一個大分子。由於原子之間相互結合的共價鍵非常強,要打斷這些鍵而使晶體熔化必須消耗大量能量,所以原子晶體一般具有較高的熔點,沸點和硬度,在通常情況下不導電,也是熱的不良導體,熔化時也不導電,但半導體硅等可有條件的導電。原子間不再以緊密的堆積為特徵,它們之間是通過具有方向性和飽和性的共價鍵相聯接,特別是通過成鍵能力很強的雜化軌道重疊成鍵,使它的鍵能接近400KJ·mol。原子晶體中配位數比離子晶體少。
原子晶體二氧化硅晶體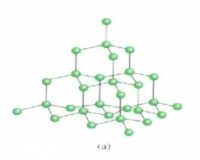

原子晶體
結構特徵:空間立體網狀結構(如金剛石、晶體硅、二氧化硅等)。
原子晶體的結構特點:
①由原子直接構成晶體,所有原子間只靠共價鍵連接成一個整體。
②由基本結構單元向空間伸展形成空間網狀結構。
③破壞共價鍵需要較高的能量。
在原子晶體的晶格結點上排列著中性原子,原子間以堅強的共價鍵相結合,如單質硅(Si)、金鋼石(C)、二氧化硅(SiO2)、碳化硅(SiC)金剛砂、金剛石(C)和氮化硼BN(立方)等。以典型原子晶體二氧化硅晶體(SiO2方石英)為例,每一個硅原子位於正四面體的中心,氧原子位於正四面體的頂點,每一個氧原子和兩硅原子相連。如果這種連接向整個空間延伸,就形成了三維網狀結構的巨型“分子”。
“比較金剛石和石英的晶體和晶胞”為金剛石面心立方晶胞。金剛砂(SiC)的結構與金剛石相似,只是C骨架結構中有將與C相連的4個C原子換為Si,再以Si為中心形成頂角為C的正四面體,形成C-Si交替的空間骨架。石英(SiO2)結構中Si和O以共價鍵相結合,每一個Si原子周圍有4個O原子排列成以Si為中心的正四面體,許許多多的Si-O四面體通過O原子相互聯接而形成巨大分子。
二維原子晶體時代的四方結構材料
某些金屬單質:晶體鍺(Ge)等。
某些非金屬化合物:氮化硼(BN)晶體。
單質:金剛石、晶體硅、晶體硼等。
化合物:碳化硅、二氧化硅等。

原子晶體
原子晶體在工業上多被用作耐磨、耐熔或耐火材料。金剛石、金剛砂都是極重要的磨料;SiO2是應用極廣的耐火材料;石英和它的變體,如水晶、紫晶、燧石和瑪瑙等,是工業上的貴重材料;SiC、BN(立方)、Si3N4等是性能良好的高溫結構材料。
社會自然地理建築科學藝術經濟軍事文化教育人物