硅
化學元素
硅(台灣、香港稱矽xī)是一種化學元素,它的化學符號是Si,舊稱矽。原子序數14,相對原子質量28.0855,有無定形硅和晶體硅兩種同素異形體,屬於元素周期表上第三周期,IVA族的類金屬元素。硅也是極為常見的一種元素,然而它極少以單質的形式在自然界出現,而是以複雜的硅酸鹽或二氧化硅的形式,廣泛存在於岩石、砂礫、塵土之中。硅在宇宙中的儲量排在第八位。在地殼中,它是第二豐富的元素,構成地殼總質量的26.4%,僅次於第一位的氧(49.4%)。

硅
1800年,戴維將其錯認為一種化合物。
1811年蓋-呂薩克和泰納爾(Thenard, Louis Jacques)加熱鉀和四氟化硅得到不純的無定形硅,根據拉丁文silex(燧石)命名為silicon。
1811年,Gay-Lussac和Thenard以矽(硅)的四氟化物與鹼土金屬反應,發現在反應當中生成赤褐色的化合物(可能是含不純物無定形的矽)。
1823年,硅首次作為一種元素被永斯·雅各布·貝采利烏斯發現,並於一年後提煉出了無定形硅,其方法與蓋-呂薩克使用的方法大致相同。他隨後還用反覆清洗的方法將單質硅提純。
1823年,Berzelius以氧化矽(硅)的粉末,加以鐵,碳的混和物在高溫下加熱,得到矽(硅)化鐵。但是為了抽取純的矽(硅),他使用矽(硅)-氟-鈣的化合物,干燒之後得到的固體,加水分解得到純的矽(硅)。
發現硅的榮譽歸屬於瑞典化學家Jöns Jacob Berzelius,在斯德哥爾摩(瑞典首都)於1824年,他通過加熱氟硅酸鉀和鉀獲取了硅。這個產物被硅酸鉀污染,但他把它放在水中攪拌,會與之反應,因此得到了相對純凈的硅粉末。
1824年永斯·雅各布·貝采利烏斯用同樣的方法,但經過反覆洗滌除去其中的氟硅酸,得到純無定形硅。
結晶性的矽則到了1854年才被提煉出來。矽(硅)的拉丁文是silicium,意為"堅硬之石"。
1854年H·S·C·德維爾第一次製得晶態硅。

單晶硅及拋光矽片
硅的DFT能帶結構
硅約佔地殼總重量的25.7%,僅次於氧。在自然界中,硅通常以含氧化合物形式存在,其中最簡單的是硅和氧的化合物硅石SiO。石英、水晶等是純硅石的變體。礦石和岩石中的硅氧化合物統稱硅酸鹽,較重要的有長石KAlSiO、高嶺土AlSiO(OH)、滑石Mg(SiO)(OH)、雲母KAl(AlSiO)(OH)、石棉HMgSiO、鈉沸石Na(AlSiO)·HO、石榴石CaAl(SiO)、鋯石英ZrSiO和綠柱石BeAlSiO等。土壤、黏土和砂子是天然硅酸鹽岩石風化后的產物。

基於硅材料的電子產品(晶元)
硅在地殼中的含量是除氧外最多的元素。如果說碳是組成一切有機生命的基礎,那麼硅對於地殼來說,佔有同樣的位置,因為地殼的主要部分都是由含硅的岩石層構成的。這些岩石几乎全部是由硅石和各種硅酸鹽組成。長石、雲母、黏土、橄欖石、角閃石等等都是硅酸鹽類;水晶、瑪瑙、碧石、蛋白石、石英、砂子以及燧石等等都是硅石。

硅原子結構三維圖
![硅[化學元素]](https://i1.twwiki.net/cover/w200/m3/0/m3038e8115eed78f894e4244721e827df.jpg)
硅[化學元素]
有無定形硅和晶體硅兩種同素異形體。晶體硅為灰黑色,無定形硅為黑色,密度2.32-2.34克/立方厘米,熔點1410℃,沸點2355℃,晶體硅屬於原子晶體。不溶於水、硝酸和鹽酸,溶於氫氟酸和鹼液。硬而有金屬光澤。
| 系列 | 類金屬 |
| 族 | ⅣA族 |
| 周期 | 3 |
| 元素分區 | p區 |
| 密度 | 2328.3 kg/m³ |
| 常見化合價 | +4 |
| 硬度 | 6.5 |
| 地殼含量 | 25.7% |
| 彈性模量 | 190GPa(有些文獻中為這個值) |
| 密度 | 2.33g/cm³(18℃) |
| 熔點 | 1687K(1414℃) |
| 沸點 | 3173K(2900℃) |
| 摩爾體積 | 12.06×10⁻⁶m³/mol |
| 汽化熱 | 384.22kJ/mol |
| 熔化熱 | 50.55 kJ/mol |
| 蒸氣壓 | 4.77Pa(1683K) |
| 間接帶隙 | 1.1eV (室溫) |
| 電導率 | 2.52×10⁻⁴ /(米歐姆) |
| 電負性 | 1.90(鮑林標度) |
| 比熱 | 700 J/(kg·K) |
原子核外電子排布:1s²2s²2p⁶ 3s²3p²;
晶胞類型:立方金剛石型;
晶胞參數:20℃下測得其晶胞參數a=0.543087nm;
顏色和外表:深灰色、帶藍色調;
採用納米壓入法測得單晶硅(100)的E為140~150GPa;
電導率:硅的電導率與其溫度有很大關係,隨著溫度升高,電導率增大,在1480℃左右達到最大,而溫度超過1600℃后又隨溫度的升高而減小。
| 電負性 | 1.90(鮑林標度) |
| 熱導率 | 148 W/(m·K) |
| 第一電離能 | 786.5 kJ/mol |
| 第二電離能 | 1577.1 kJ/mol |
| 第三電離能 | 3231.6 kJ/mol |
| 第四電離能 | 4355.5 kJ/mol |
| 第五電離能 | 16091 kJ/mol |
| 第六電離能 | 19805 kJ/mol |
| 第七電離能 | 23780 kJ/mol |
| 第八電離能 | 29287 kJ/mol |
| 第九電離能 | 33878 kJ/mol |
| 第十電離能 | 38726 kJ/mol |
同位素:
| 符號 | Z(p) | N(n) | 質量(u) | 半衰期 | 原子核自旋 | 相對丰度 | 相對丰度的變化量 |
| 22Si | 14 | 8 | 22.03453(22)# | 29(2)ms | 0+ | ||
| 23Si | 14 | 9 | 23.02552(21)# | 42.3(4)ms | 3/2+# | ||
| 24Si | 14 | 10 | 24.011546(21) | 140(8)ms | 0+ | ||
| 25Si | 14 | 11 | 25.004106(11) | 220(3)ms | 5/2+ | ||
| 26Si | 14 | 12 | 25.992330(3) | 2.234(13)s | 0+ | ||
| 27Si | 14 | 13 | 26.98670491(16) | 4.16(2)s | 5/2+ | ||
| 28Si | 14 | 14 | 27.9769265325(19) | 穩定 | 0+ | 0.92223(19) | 0.92205-0.92241 |
| 29Si | 14 | 15 | 28.976494700(22) | 穩定 | 1/2+ | 0.04685(8) | 0.04678-0.04692 |
| 30Si | 14 | 16 | 29.97377017(3) | 穩定 | 0+ | 0.03092(11) | 0.03082-0.03102 |
| 31Si | 14 | 17 | 30.97536323(4) | 157.3(3)min | 3/2+ | ||
| 32Si | 14 | 18 | 31.97414808(5) | 170(13)a | 0+ | ||
| 33Si | 14 | 19 | 32.978000(17) | 6.18(18)s | (3/2+) | ||
| 34Si | 14 | 20 | 33.978576(15) | 2.77(20) s | 0+ | ||
| 35Si | 14 | 21 | 34.98458(4) | 780(120) ms | 7/2-# | ||
| 36Si | 14 | 22 | 35.98660(13) | 0.45(6)s | 0+ | ||
| 37Si | 14 | 23 | 36.99294(18) | 90(60)ms | (7/2-)# | ||
| 38Si | 14 | 24 | 37.99563(15) | 90# ms [>1 µ;s] | 0+ | ||
| 39Si | 14 | 25 | 39.00207(36) | 47.5(20) ms | 7/2-# | ||
| 40Si | 14 | 26 | 40.00587(60) | 33.0(10) ms | 0+ | ||
| 41Si | 14 | 27 | 41.01456(198) | 20.0(25) ms | 7/2-# | ||
| 42Si | 14 | 28 | 42.01979(54)# | 13(4) ms | 0+ | ||
| 43Si | 14 | 29 | 43.02866(75)# | 15# ms [>260 ns] | 3/2-# | ||
| 44Si | 14 | 30 | 44.03526(86)# | 10# ms | 0+ |
備註:1.畫上#號的數據代表沒有經過實驗的證明,只是理論推測而已,而用括弧括起來的代表數據不確定性。
2.有三種天然的穩定同位素Si(92.2%)、Si(4.7%)和Si(3.1%),還有質量數為25、26、27、31和32的人工放射性同位素。
3.硅(原子質量單位: 28.0855,共有23種同位素,其中有3種同位素是穩定的。
硅有明顯的非金屬特性,可以溶於鹼金屬氫氧化物溶液中,產生(偏)硅酸鹽和氫氣。
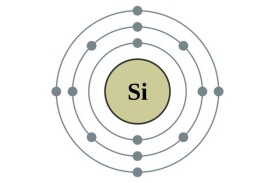
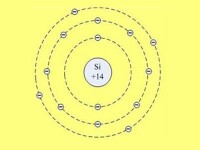
硅原子位於元素周期表第IV主族,它的原子序數為Z=14,核外有14個電子。電子在原子核外,按能級由低硅原子到高,由里到外,層層環繞,這稱為電子的殼層結構。硅原子的核外電子第一層有2個電子,第二層有8個電子,達到穩定態。最外層有4個電子即為價電子,它對硅原子的導電性等方面起著主導作用。
正因為硅原子有如此結構,所以有其一些特殊的性質:最外層的4個價電子讓硅原子處於亞穩定結構,這些價電子使硅原子相互之間以共價鍵結合,由於共價鍵比較結實,硅具有較高的熔點和密度;化學性質比較穩定,常溫下很難與其他物質(除氟化氫和鹼液以外)發生反應;硅晶體中沒有明顯的自由電子,能導電,但導電率不及金屬,且隨溫度升高而增加,具有半導體性質。
加熱下能同單質的鹵素、氮、碳等非金屬作用,也能同某些金屬如Mg、Ca、Fe、Pt等作用。生成硅化物。不溶於一般無機酸中,可溶於鹼溶液中,並有氫氣放出,形成相應的鹼金屬硅酸鹽溶液,於赤熱溫度下,與水蒸氣能發生作用。
分類:純凈物、單質、非金屬單質。
(1)與單質反應:
Si + O₂ == SiO₂,條件:加熱
Si + 2F₂ == SiF₄
Si + 2Cl₂ == SiCl₄,條件:高溫
(2)高溫真空條件下可以與某些氧化物反應:
2MgO + Si=高溫真空 =Mg(g)+SiO₂(硅熱還原法煉鎂)
(3)與酸反應:
只與氫氟酸反應:Si + 4HF == SiF₄↑ + 2H₂↑
(4)與鹼反應:Si + 2OH⁻+ H₂O == SiO₃²⁻+ 2H₂↑(如NaOH,KOH)
注意:硅、鋁是既能和酸反應,又能和鹼反應,放出氫氣的單質。
相關方程式:
Si+O₂=高溫= SiO₂
Si + 2OH⁻ + H₂O == SiO₃²⁻+ 2H₂↑
Si+2F₂== SiF₄
Si+4HF== SiF₄↑+2H₂↑
SiO₂ + 2OH⁻== SiO₃²⁻+ H₂O
SiO₃²⁻+ 2NH₄⁺+ H₂O == H₄SiO₄↓ + 2NH₃↑
SiO₃²⁻+ CO₂ + 2H₂O == H₄SiO₃↓+ CO₃²⁻
SiO₃²⁻+ 2H⁺== H₂SiO₃↓
SiO₃²⁻+2H⁺+H₂O == H₄SiO₄↓
硅原子結構二維圖
3SiO₃²⁻+ 2Fe³⁺== Fe₂(SiO₃)₃↓
3SiO₃²⁻+2Al³⁺==Al₂(SiO₃)₃↓
Na₂CO₃ + SiO₂ =高溫= Na₂SiO₃ + CO₂ ↑
相關化合物:
二氧化硅、硅膠、硅酸鹽、硅酸、原硅酸、硅烷、二氯硅烷、三氯硅烷、四氯硅烷、
原子屬性:
原子量:28.0855u;
原子核虧損質量:0.1455u;
原子半徑:(計算值)110(111)pm;
共價半徑:111 pm;
范德華半徑:210 pm;
外圍電子層排布:3s²3p²;引
電子在每個能級的排布:2,8,4;
電子層:KLM;
氧化性(氧化物):4(兩性的)。
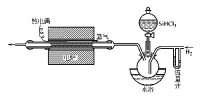
硅的製取裝置
用鎂還原二氧化硅可得無定形硅。用碳在電爐中還原二氧化硅可得晶體硅。電子工業中用的高純硅則是用氫氣還原三氯氫硅或四氯化硅而製得。

硅晶圓片
2、金屬陶瓷、宇宙航行的重要材料。將陶瓷和金屬混合燒結,製成金屬陶瓷複合材料,它耐高溫,富韌性,可以切割,既繼承了金屬和陶瓷的各自的優點,又彌補了兩者的先天缺陷。可應用于軍事武器的製造。第一架太空梭“哥倫比亞號”能抵擋住高速穿行稠密大氣時摩擦產生的高溫,全靠它那三萬一千塊硅瓦拼砌成的外殼。
3、光導纖維通信,最新的現代通信手段。用純二氧化硅可以拉制出高透明度的玻璃纖維。激光可在玻璃纖維的通路里,發生無數次全反射而向前傳輸,代替了笨重的電纜。光纖通信容量高,一根頭髮絲那麼細的玻璃纖維,可以同時傳輸256路電話;而且它還不受電、磁的干擾,不怕竊聽,具有高度的保密性。光纖通信將會使21世紀人類的生活發生革命性巨變。
4、性能優異的硅有機化合物。例如有機硅塑料是極好的防水塗布材料。在地下鐵道四壁噴塗有機硅,可以一勞永逸地解決滲水問題。在古文物、雕塑的外表,塗一層薄薄的有機硅塑料,可以防止青苔滋生,抵擋風吹雨淋和風化。天安門廣場上的人民英雄紀念碑,便是經過有機硅塑料處理表面的,因此永遠潔白、清新。
5、由於有機硅獨特的結構,兼備了無機材料與有機材料的性能,具有表面張力低、粘溫係數小、壓縮性高、氣體滲透性高等基本性質,並具有耐高低溫、電氣絕緣、耐氧化穩定性、耐候性、難燃、憎水、耐腐蝕、無毒無味以及生理惰性等優異特性,廣泛應用於航空航天、電子電氣、建築、運輸、化工、紡織、食品、輕工、醫療等行業,其中有機硅主要應用於密封、粘合、潤滑、塗層、表面活性、脫模、消泡、抑泡、防水、防潮、惰性填充等。隨著有機硅數量和品種的持續增長,應用領域不斷拓寬,形成化工新材料界獨樹一幟的重要產品體系,許多品種是其他化學品無法替代而又必不可少的。
6、硅可以提高植物莖稈的硬度,增加害蟲取食和消化的難度。儘管硅元素在植物生長發育中不是必需元素,但它也是植物抵禦逆境、調節植物與其他生物之間相互關係所必需的化學元素。
硅在提高植物對非生物和生物逆境抗性中的作用很大,如硅可以提高植物對乾旱、鹽脅迫、紫外輻射以及病蟲害等的抗性。硅可以提高水稻對稻縱卷葉螟的抗性,施用硅后水稻對害蟲取食的防禦反應迅速提高,硅對植物防禦起到警備作用。
水稻在受到蟲害襲擊時,硅可以警備水稻迅速激活與抗逆性相關的茉莉酸途徑,茉莉酸信號反過來促進硅的吸收,硅與茉莉酸信號途徑相互作用影響著水稻對害蟲的抗性。

單晶硅棒
硅在結締組織、軟骨形成中硅是必需的,硅能將粘多糖互相連結,並將粘多糖結合到蛋白質上,形成纖維性結構,從而增加結締組織的彈性和強度,維持結構的完整性;硅參與骨的鈣化作用,在鈣化初始階段起作用,食物中的硅能增加鈣化的速度,尤其當鈣攝入量低時效果更為明顯;膠原中氨基酸約21%為羥脯氨酸,脯氨醯羥化酶使脯氨酸羥基化,此酶顯示最大活力時需要硅;通過對不同來源的膠原分析,結果顯示硅是膠原組成成分之一。
參考攝入量:由於沒有人體硅需要量的實驗資料,因此難以提出合適的人體每日硅的需求量,由動物實驗推算,硅若易吸收,每天人體的需要量可能為2~5mg。但膳食中大部分的硅不易被吸收,推薦攝入量每天約為5~10mg,可以認為每日攝入20~50mg是適宜的。
過量表現:高硅症,高硅飲食的人群中曾發現局灶性腎小球腎炎,腎組織中含硅量明顯增高的個體。也有報道有人大量服用硅酸鎂(含硅抗酸劑)可能誘發人類的尿路結石。
硅肺病,經呼吸道長期吸入大量含硅的粉塵,可引起矽肺。

硅單晶懸浮區熔爐
不足表現:飼料中缺少硅可使動物生長遲緩、缺乏導致頭髮、指甲易斷裂,皮膚失去光澤。動物試驗結果顯示,喂飼致動脈硬化飲料的同時補充硅,有利於保護動物的主動脈的結構。另外,已確定血管壁中硅含量與人和動物粥樣硬化程度呈反比。在心血管疾病長期發病率相差兩部的人群中,其飲用水中硅的含量也相差約兩倍,飲用水硅含量高的人群患病較少。
硅是一種非常安全的物質,本身不予免疫系統反應,也不會被細胞吞噬,更不會滋生細菌或與化學物質發生反應,同時還可以有針對皮膚傷口所開發生產的硅膠,可以用來保護傷口,是安全性非常高的材料,受各國衛生機關許可使用。
謠言:在自然界中,硅都以含氧化合物形式存在。
駁斥:自然界存在天然的硅單質且早有報道,下為文獻報道節選
本文對自然硅進行了礦相學、礦物學研究。該礦物產於福建某地矽卡岩型硫、多金屬礦床中。自然硅呈亮灰銀白色、強金屬光澤。性脆。鏡下呈渾圓粒狀、乳滴狀。均質。實測比重d=2.368。硬度H_M=6.76。反射率 R 470nm 37.08;546nm 33.44;589nm 31.27;650nm 29.96。經掃描電鏡能譜分析、電子探針分析,Si 99.87%~99.94%。