細胞程序性死亡
細胞程序性死亡
在細胞凋亡一詞出現之前,胚胎學家已觀察到動物發育過程中存在著細胞程序性死亡(programmed cell death,PCD)現象,近年來PCD和細胞凋亡常被作為同義詞使用,但兩者實質上是有差異的。PCD是一個功能性概念,描述在一個多細胞生物體中,某些細胞的死亡是個體發育中一個預定的,並受到嚴格控制的正常組成部分,而凋亡是一個形態學概念;PCD應包括細胞凋亡,程序壞死,以及最新發現的細胞焦亡(丁明孝等編《細胞生物學第五版》 )。而現行人教版高中生物教材將概念簡化易造成誤解,即將凋PCD等同於細胞凋亡。
細胞程序性死亡是生物體發育過程中普遍存在的,是一個由基因決定的細胞主動的有序的死亡方式。具體指細胞遇到內、外環境因子刺激時,受基因調控啟動的自殺保護措施,包括一些分子機制的誘導激活和基因編程,通過這種方式去除體內非必需細胞或即將發生特化的細胞。
而細胞發生程序性死亡時,就像樹葉或花的自然凋落一樣,凋亡的細胞散在於正常組織細胞中,無炎症反應,不遺留瘢痕。死亡的細胞碎片很快被巨噬細胞或鄰近細胞清除,不影響其他細胞的正常功能。
儘管早在170年前,人們就在細胞中觀察到了自然發生的細胞死亡現象,然而長期以來它都被視為是一種細胞被動現象,以及生物系統的一個必然歸宿點。直到科學家們逐漸展開對蠶和蝌蚪的發育定時細胞死亡研究,這一觀念才開始發生改變。科學家們在這些早期的研究中發現當蛋白質或RNA合成受到抑制時有可能導致細胞死亡發生延遲,神經細胞的存活需要一類稱作神經營養因子的細胞外存活因子的支持。最初人們只是將神經營養因子視為是細胞存活必需的一種特殊的營養物質,然而後來的研究證實這些因子是通過抑制細胞內自殺性程序來支持細胞存活的。更深入的研究表明這一機制並不僅局限於神經系統,這種對於細胞外存活信號的競爭是一種廣泛存在於動物體內控制細胞數量的重要機制。
細胞死亡領域的另一個里程碑式成果是Kerr,Wylie和Currie開展的細胞超微結構研究,確定了生理條件下瀕死細胞一系列的細胞形態學變化。當細胞對無法承受的壓力或損害做出死亡反應時,細胞會發生膨脹和破裂,這一過程稱之為壞死(necrosis)。而在正常發育和內環境穩定過程中,大部分細胞死亡時則表現為細胞體積縮小、核固縮、胞膜結構完整、最終細胞遺骸被分割為凋亡小體,並迅速被周圍專職或非專職吞噬細胞吞噬。而研究則揭示出凋亡並非發育細胞死亡的唯一形式,當PCD受到抑制時細胞還可能存在有其他的補償機制。此外,科學家們還在線蟲研究中揭示了細胞發生PCD的遺傳學分子機制,鑒別出了對PCD產生特殊效應的一些突變,證實細胞死亡是通過一些特殊基因啟動細胞自殺程序的細胞發育的最終命運。在對相應基因的分子特徵鑒定中確定了在進化中保守的核心的細胞死亡機器,以及作為細胞凋亡的中心環節和關鍵執行者caspases家族。
凋亡細胞的主要特徵是(參見表15-2):①染色質聚集、分塊、位於核膜上,胞質凝縮,最後核斷裂,細胞通過出芽的方式形成許多凋亡小體(圖15-4);②凋亡小體內有結構完整的細胞器,還有凝縮的染色體,可被鄰近細胞吞噬消化,因始終有膜封閉,沒有內溶物釋放,故不會引起炎症;③凋亡細胞中仍需要合成一些蛋白質,但是在壞死細胞中ATP和蛋白質合成受阻或終止;④核酸內切酶活化,導致染色質DNA在核小體連接部位斷裂,形成約200bp整數倍的核酸片段,凝膠電泳圖譜呈梯狀;⑤凋亡通常是生理性變化,而細胞壞死是病理性變化。
| 區別點 | 細胞凋亡 | 細胞壞死 |
| 起因 | 生理或病理性 | 病理性變化或劇烈損傷 |
| 範圍 | 單個散在細胞 | 大片組織或成群細胞 |
| 細胞膜 | 保持完整,一直到形成凋亡小體 | 破損 |
| 染色質 | 凝聚在核膜下呈半月狀 | 呈絮狀 |
| 細胞器 | 無明顯變化 | 腫脹、內質網崩解 |
| 細胞體積 | 固縮變小 | 腫脹變大 |
| 凋亡小體 | 有,被鄰近細胞或巨噬細胞吞噬 | 無,細胞自溶,殘餘碎片被巨噬細胞吞噬 |
| 基因組DNA | 有控降解,電泳圖譜呈梯狀 | 隨機降解,電泳圖譜呈塗抹狀 |
| 蛋白質合成 | 有 | 無 |
| 調節過程 | 受基因調控 | 被動進行 |
| 炎症反應 | 無,不釋放細胞內容物 | 有,釋放內容物。 |
關於PCD的作用及調控機制的大部分研究數據主要來自於三種模型系統:線蟲、果蠅和小鼠。線蟲中的體細胞程序性死亡是一個受到細胞系嚴密調控的細胞命運過程。在雌雄同體線蟲的發育過程中,1090個體細胞中的131個會發生死亡,其中大部分發生在胚胎髮育過程中或是細胞分裂后不久。當線蟲的PCD發生異常時,這131個細胞將免於細胞死亡,但對線蟲的發育、壽命、行為和外表似乎並不產生顯著性的影響。
研究PCD的另一個重要模型就是黑腹果蠅(Drosophila melanogaster)。黑腹果蠅中的細胞數目比線蟲要多出1000多倍,它的細胞數目受到營養供應、DNA損傷和環境壓力等環境因素的影響。在果蠅中,PCD並非是由細胞系確定的程式化的細胞命運過程,而是更多地像脊椎動物一樣,受到各種細胞內外的刺激調控。果蠅有著確定的發育機制,相對簡單的解剖結構,便於遺傳及分子生物技術操作。因此它為研究發育過程中PCD的作用以及信號調控機制提供了一個重要的系統。不同於線蟲,PCD是果蠅完全發育所必需的過程,抑制PCD會導致果蠅嚴重的發育缺陷和生物體死亡。
正如人們可以預期的,在脊椎動物中的PCD調控則似乎要複雜得多,在整個發育的過程中從早期胚泡中的內細胞團分化到成體維持組織內環境穩定,大量的細胞都經受了PCD。讓人感到有些驚異的是,在小鼠中的某些細胞死亡基因的失活僅導致相對較小的發育缺陷,並且在胚胎髮育中存活下來。其中的原因之一看起來是由於相當豐富的caspase家族以及存在多重caspase激活的機制。此外,有數據表明當發生凋亡缺陷時,細胞可能啟動了其他的備用機制。儘管在哺乳動物中存在著健全的細胞死亡機制,然而凋亡異常仍與一些特異性的發育障礙和癌症及退行性疾病等多種疾病顯示了相關性。
這一研究已從線蟲、果蠅和小鼠向其他的生物系統包括水螅、煙草天峨、非洲蟾蜍、雞以及人類患者延伸。
PCD作為細胞的一種基本生物學現象,在多細胞生物去除不需要的或異常的細胞中起著必要的作用。它在生物體的進化、內環境的穩定以及多個系統的發育中發揮重要的作用。這一過程調控異常與免疫性疾病和發育障礙、神經退行性病變和癌症等多種人類疾病密切相關。因而,程序性細胞死亡不僅是一種特殊的細胞死亡類型,而且具有重要的生物學意義及複雜的分子生物學機制。
PCD在器官發生和組織重塑中發揮至關重要的作用。其中眾所周知的就是高等脊椎動物中手指(腳趾)的形成。在胚胎髮育期間藉助於指間的細胞凋亡,我們才有了手指而不是鴨蹼。凋亡是形成四肢的主要細胞死亡機制,在小鼠中促凋亡基因的失活可部分地保留趾間組織。在果蠅中,凋亡對腿關節的形成以及分節形態發育起關鍵性的作用。
在發育的過程中,機體藉助於PCD清除掉那些不再需要的,發揮過渡功能的結構。其中包括進化殘留物、單性別中需要或僅短暫發揮功能的結構。例如,人在胚胎階段是有尾巴的,正因為組成尾巴的細胞恰當地死亡,才使我們在出生后沒有尾巴。如果這些細胞沒有恰當地死亡,就會出現長尾巴的新生兒。
發育中的組織和器官主要依賴於細胞分裂和PCD之間的動態平衡以維持適當的細胞數目。大多數的器官,例如神經細胞、免疫系統和生殖系統均藉助於PCD清除過度生成的細胞。在女性體內,藉助PCD可清除掉近80%的卵母細胞。在哺乳動物中樞神經系統超過一半的神經元通過PCD清除。對有限存活信號的競爭確保了組織中不同細胞類型的適當比例。相同的競爭也存在於以不同速率增殖的細胞間。分裂較慢的細胞就會被快速分裂的細胞淘汰。細胞競爭被認為促成了生長平衡,對正常發育過程中可能存在的變異進行調整,挑選出有利於器官功能的最適合的細胞。
PCD還可在發育階段和成人後的生命過程中發揮保護作用清除異常及潛在危險的細胞。
凋亡信號通路
當細胞接受凋亡信號分子(Fas,TNF等)后,凋亡細胞表面信號分子受體相互聚集並與細胞內的銜接蛋白(Adaptor protein)結合,這些銜接蛋白又募集Procaspases聚集在受體部位,Procaspase相互活化併產生級聯反應,使細胞凋亡。
·下游Caspases活化后,作用底物:
裂解核纖層蛋白,導致細胞核形成凋亡小體;
裂解DNase結合蛋白,使DNase釋放,降解DNA形成DNA Ladder;
裂解參與細胞連接或附著的骨架和其他蛋白,使凋亡細胞皺縮、脫落,便於細胞吞噬;
導致膜脂PS重排,便於吞噬細胞識別并吞噬。
Bcl-2是一種原癌基因,是ced-9在哺乳類中的同源物,能抑制細胞凋亡;與線粒體及內質網膜相結合;Bcl-2蛋白的羧基末端有一穿膜的結構域;Bcl-2家族成員的基因中,常常含有三個保守的Bcl-2同源區,即BH1,BH2和BH3
Bcl-2、線粒體與細胞凋亡
哺乳動物細胞中發現的Apaf2(凋亡蛋白酶活化因子)即是CytC當Caspase8活化后,它一方面作用於Procaspase3,另一方面使Bid裂解成2個片段,其中含BH3結構域的C-端片段被運送到線粒體,與Bcl-2/Bax的BH3結構域形成複合物,導致細胞色素C釋放。CytC與胞質中Ced4同源物Apaf-1(凋亡蛋白酶活化因子apoptosis protease activating factor)結合併活化Apaf-1,活化的Apaf-1再活化Procaspase9,最後引起細胞凋亡。
P53引起的內源性凋亡通路
P53可直接解除Bcl-2對Bax/Bak的結合抑制,從而觸發內源途徑。
來自耶魯大學醫學院,浙江大學遺傳學研究院的研究人員發表了題為“Mitochondrial Stress Engages E2F1 Apoptotic Signaling to Cause Deafness”的文章,發現線粒體DNA突變能開啟一種信號級聯放大過程,從而導致細胞程序性死亡,這揭示了母系遺傳學耳聾的病理分子途徑。
研究人員聚焦於一個線粒體DNA突變,這一突變會引起母系遺傳學耳聾,這一突變出現在編碼線粒體核糖體RNA中的一個基因上,這一基因能編碼細胞呼吸所需的蛋白,研究人員發現具有這種突變的細胞系很容易發生細胞死亡,但這種死亡並不是直接由這種突變引發,而是由於這種突變能增強這種RNA正常的化學甲基化修飾。
研究人員發現病變線粒體的活性氧分子就是這一細胞死亡-誘導基因表達過程中的啟動因素,他們進一步通過了這一蛋白的遺傳消耗實驗,能恢復小鼠正常的聽力,證明了這一機理。
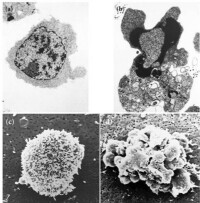
左,正常胸腺細胞;右,凋亡胸腺細胞
控制“程序性細胞死亡”的基因有兩類:一類是抑制細胞死亡的;另一類是啟動或促進細胞死亡的。兩類基因相互作用控制細胞正常死亡。如果能發現所有的調控基因,分析其功能,研究出能發揮或抑制這些基因功能的藥物,那麼人類就能夠敲響癌症和艾滋病的喪鐘。
線蟲Caenorhabditiselegans是研究個體發育和細胞程序性死亡的理想材料。其生命周期短,細胞數量少,成熟的成蟲若是雌雄同體則有959個體細胞,約2000個生殖細胞。若是雄蟲則有1031個體細胞和約1000個生殖細胞。神經系統由302個細胞組成,這些細胞來自於407個前體細胞,這些前體細胞中有105個發生了程序死亡。
麻省理工學院的Robert Horvitz領導的研究小組採用體細胞突變的方法發現共有14個基因在C.elegans細胞凋亡中起作用,其中在細胞凋亡的實施階段起作用的主要有3個:Ced-3、Ced-4和Ced-9,其中Ced-3和Ced-4的作用是誘發凋亡,在缺乏Ced-3、Ced-4的突變體中不發生凋亡,有多餘細胞存在。Ced-9抑制Ced-3、Ced-4的作用,使凋亡不能發生,Ced-9功能不足導致胚胎因細胞過度凋亡而死亡。
當然,這個過程需經過一番艱苦努力,因為線蟲只有959個細胞,而人體則有大約1000萬億個細胞。

2002年諾貝爾生理與醫學獎獲得者