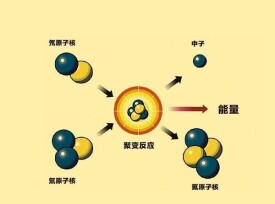
反氘核
反氘核
拼音:dāo
英文:deuterium
同義詞條:重氫
中文名稱:氘
英文名稱:deuterium
所屬學科:大氣科學(一級學科) ;大氣化學(二級學科)
自1919年F.W.阿斯頓用質譜儀發現大多數元素有同位素后,人們試圖發現氫的重同位素,並用來解釋氫的原子量1.00777小數上的增值。1919年,O.斯特恩和M.福爾默爾企圖用擴散法分離氫同位素,未得到預期的結果。1927年阿斯頓以16O的原子量為16.00000作基準測得氫的原子量為1.00778,與化學法測得的氫原子量 1.00777相符而認為氫是單一同位素的元素。1929年發現天然氧是由三種同位素組成的,從而出現了原子量化學標度和物理標度的差異。質譜法測定的氫原子量換算成化學標度后變成1.00756,比化學測定值小0.00021。1931年R.T.伯奇和D.H.門澤爾根據此差值指出,應有質量數為2的氫同位素存在,並估計出。1931年底H.C.尤里、F.G.布里克韋德和G.M.默菲將4升液氫在三相點溫度(14K)緩慢蒸發到只剩1毫升殘液,然後用光柵光譜分析,結果在巴耳末線中發現質量數為2的氫同位素的譜線,從而發現了重氫。尤里因此獲得1934年諾貝爾化學獎。
氕和氘的質量比為,是所有穩定同位素中質量相差最大的一對同位素,因此表現在物理性質上的差異也最大(見表)氘具有較低的零點能和較小的碰撞頻率,導致其化學反應性比氫低。氘的核自旋量子數為1,所以D2分子存在正仲分子。氘可以生成各種含氘化合物,最重要的氘化合物是重水。
天然氫中含有質量數為1的氕(H),質量數為2的氘(D)約,還含有痕量的質量數為3的氫的放射性同位素氚(T)約。氕和氘可以結合成三種分子:輕氫、半重氫HD和重氫。由於平衡的存在,且平衡常數約等於4,在天然氫中主要存在和HD分子。
液氫精餾是現代分離氘的有效方法之一。但在低溫蒸餾時首先濃集的是HD,必須經催化劑轉化為的平衡混合物后才能繼續精餾濃集。
有科學研究表明,氘(D)對生命體的生存發展和繁衍是有害的。氘(D)置換氫原子可以在DNA的螺旋結構中產生附加應力,造成雙螺旋的相移、斷裂、替換,使脫氧核糖核酸排列混亂,甚至重新合成,出現突變。生命機體對氘(D)沒有任何抵禦能力,一旦進入生命體后很難代謝出去,在體內有累加作用,所以高含量的氘(D)對人體的遺傳、代謝和酶系等有不良影響。
對生命體的毒害就越大,因此包括人在內的各種動植物生命體始終都在受到不同程度的氘(D)中毒,只不過它們現在對於自然中的比值的含氘(D)量已經產生了適應性。氘(D)對生命體的作用,最直接的是通過水完成的。研究表明,在水中不論氘(D)的含量多少對生命體都是有毒的。如果自然水中 超過了正常值時,對生命體的毒害就更大了。
氘(D)對人體所產生的有害影響就越小。輕水試驗表明,含氘(D)量低的雪水即輕水有抗衰老作用。科學家還指出,鯨魚之所以長得很大,並生活在接近冰山的融冰邊緣區域而不在赤道區,是因為寒冷極地附近水中的含氘(D)量少,魚類和浮游生物也容易繁殖。侏儒人和矮小動物主要生活在氘(D)含量多的赤道非洲西部,而大型非洲動物象和河馬均在氘(D)的含量比正常值少的非洲東部。長壽的人也都生活在氘(D)含量少的北方和山地。因此氕氧輕水是“生命之水”的“聖水”, 氘氧重水則是危害和毀滅生命的禍水。水中含氘(D)量的多少對生命體進退存亡發展的這個決定性作用。鑒於氘(D)對生命體潛在的威脅,現代科學家正試圖創造一種氘(D)含量低的飲用水,以此提高人類的生活質量。目前,日本、歐洲、美國的科學家都開展了相關研究,我國科學家也正在對低氘水(DDW)作系統研究,相信很快就能為人們提供一種真正的“上善之水”。