基因編輯
基因工程技術
基因編輯(gene editing)是一種基因工程技術。基因編輯(gene editing),又稱基因組編輯(genome editing)或基因組工程(genome engineering),是一種新興的比較精確的能對生物體基因組特定目標基因進行修飾的一種基因工程技術。
2021年2月,《最高人民法院最高人民檢察院關於執行,<中華人民共和國刑法>確定罪名的補充規定(七)》規定了非法植入基因編輯、克隆胚胎罪罪名。
基因編輯是一種新興的比較精確的能對生物體基因組特定目標基因進行修飾的一種基因工程技術或過程。
早期的基因工程技術只能將外源或內源遺傳物質隨機插入宿主基因組,基因編輯則能定點編輯想要編輯的基因。
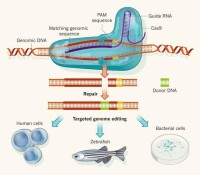
基因編輯依賴於經過基因工程改造的核酸酶,也稱“分子剪刀”,在基因組中特定位置產生位點特異性雙鏈斷裂(DSB),誘導生物體通過非同源末端連接(NHEJ)或同源重組(HR)來修復DSB,因為這個修復過程容易出錯,從而導致靶向突變。這種靶向突變就是基因編輯。
基因編輯以其能夠高效率地進行定點基因組編輯,在基因研究、基因治療和遺傳改良等方面展示出了巨大的潛力。
同源重組(Homologous recombination)是最早用來編輯細胞基因組的技術方法。同源重組是在DNA的兩條相似(同源)鏈之間遺傳信息的交換(重組)。通過生產和分離帶有與待編輯基因組部分相似的基因組序列的DNA片段,將這些片段注射到單核細胞中,或者用特殊化學物質使細胞吸收,這些片段一旦進入細胞,便可與細胞的DNA重組,以取代基因組的目標部分。這種方法的缺點是效率極低,且出錯率高。
基因編輯的關鍵是在基因組內特定位點創建DSB。常用的限制酶在切割DNA方面是有效的,但它們通常在多個位點進行識別和切割,特異性較差。為了克服這一問題並創建特定位點的DSB,人們對四種不同類型的核酸酶(Nucleases)進行了生物工程改造。它們分別是巨型核酸酶(Meganuclease)、鋅指核酸酶(ZFNs),轉錄激活樣效應因子核酸酶(TALEN)和成簇規律間隔短迴文重複(CRISPR / Cas9)系統。ZFN、TALEN和巨型核酸酶被Nature Methods選為2011年度方法。 CRISPR-Cas系統被科學界選為2015年度最佳突破。
巨型核酸酶
巨型核酸酶是一種脫氧核糖核酸內切酶,其特徵在於它的識別位點較大(12至40個鹼基對的雙鏈DNA序列)。因此,該位點通常在任何給定的基因組中僅發生一次。因此,巨型核酸酶被認為是最特異的天然存在的核酸酶。
鋅指核酸酶
鋅指核酸酶是一個經過人工修飾的核酸酶,它通過將一個鋅指DNA結合結構域與核酸酶的一個DNA切割結構域融合而產生。通過設計鋅指結構域就可以實現對目的基因的特定DNA序列的靶向切割,這也使得鋅指核酸酶能夠定位於複雜基因組內的獨特的靶向序列。通過利用內源DNA修復機制,鋅指核酸酶可用於精確修飾高等生物的基因組。
轉錄激活樣效應因子核酸酶
TALEN是經過基因工程改造后的可以切割特定DNA序列的限制酶。TALEN是通過將一個TAL效應子DNA結合結構域與核酸酶的一個DNA切割結構域融合而獲得的。TALENs可以被設計成與幾乎任何所需的DNA序列結合,因此當與核酸酶結合時,DNA可以在特定位置進行切割。
成簇規律間隔短迴文重複
CRISPR-Cas是原核生物免疫系統,賦予原核生物對如存在於質粒和噬菌體中的外來遺傳物質的抗性,是一種獲得性免疫系統。攜帶間隔序列的RNA有助於Cas(CRISPR相關)蛋白識別並切割外源致病DNA。其它RNA指導的Cas蛋白切割外源RNA 。
CRISPR-Cas系統是應用最廣泛的基因編輯工具。
核酸酶的精確度和效率
在上述幾種核酸酶中效率最低的是巨型核酸酶,受到其DNA結合元件和切割元件制約,它在每1,000個核苷酸中才能識別一個潛在的靶標。開發ZFN克服了巨型核酸酶的局限性,ZFN在每140個核苷酸中可有一個識別位點。但因為DNA結合元件的相互影響,巨型核酸酶和ZFN兩種方法的精確度都是不可預測的。因此,需要高度專業知識和冗長且昂貴的驗證過程。 TALEN是最精確和特異的核酸酶,比前兩種方法有更高的效率。因為DNA結合元件由一系列TALE亞基組成,每個亞基具有識別獨立於其他亞基的特定DNA核苷酸鏈的能力,從而產生具有高精度的更高數目的靶位點。生產一個新的TALEN核酸酶大約需要一周時間和幾百美元。與TALE核酸酶相比,CRISPR核酸酶的精確度略低。這是由於CRISPR-Cas需要在一端擁有一個特定核苷酸以產生CRISPR修復斷裂雙鏈的指導RNA。但CRIPSR-Cas已被證明是最快捷、最便宜的方法,只花費不到兩百美元和幾天的時間。CRISPR對ZFN和TALEN方法的一個主要優點是可以使用其~80nt CRISPR sgRNA直接定位不同的DNA序列,而ZFN和TALEN方法都需要對定位到每個DNA序列的蛋白質進行構建和測試。
活性核酸酶的脫靶效應可能會在遺傳和生物水平上產生潛在的危險。研究發現,ZFNs往往比TALEN方法或CRISPR-Cas具有更多的細胞毒性,而TALEN和CRISPR-Cas的方法往往具有最高的效率和較少的脫靶效應。這些核酸酶中,TALEN方法精確度最高
基因編輯已經開始應用於基礎理論研究和生產應用中,這些研究和應用,有助於生命科學的許多領域,從研究植物和動物的基因功能到人類的基因治療。下面主要介紹基因編輯在動植物上的應用。
基因編輯和牛體外胚胎培養等繁殖技術結合,允許使用合成的高度特異性的內切核酸酶直接在受精卵母細胞中進行基因組編輯。 CRISPR -Cas9進一步增加了基因編輯在動物基因靶向修飾的應用範圍。CRISPR-Cas9允許通過細胞質直接注射(CDI)從而實現對哺乳動物受精卵多個靶標的一次性同時敲除(KO) 。
單細胞基因表達分析已經解決了人類發育的轉錄路線圖,從中發現了關鍵候選基因用於功能研究。使用全基因組轉錄組學數據指導實驗,基於CRISPR的基因組編輯工具使得干擾或刪除關鍵基因以闡明其功能成為可能。
植物基因的靶向修飾是基因編輯應用最廣泛的領域。首先可以通過修飾內源基因來幫助設計所需的植物性狀。例如,可以通過基因編輯將重要的性狀基因添加到主要農作物的特定位點,通過物理連接確保它們在育種過程中的共分離,這又稱為“性狀堆積”。其次,可以產生耐除草劑作物。比如,使用ZFN輔助的基因打靶,將兩種除草劑抗性基因(煙草乙醯乳酸合成酶SuRA和SuRB)引入作物。再次,可以用來防治各種病害如香蕉的條紋病毒。
此外,基因編輯技術還被應用於改良農產品質量,比如改良豆油品質 和增加馬鈴薯的儲存潛力。
2019年8月27日,美國科學家藉助基因編輯技術CRISPR-Cas9,製造出了第一種經過基因編輯的爬行動物——一些小型白化蜥蜴,這是該技術首次用於爬行動物。由於白化病患者經常有視力問題,因此,最新突破有助於研究基因缺失如何影響視網膜發育。
領導研究的筑波大學教授江面浩說,基因編輯能大幅縮短作物品種改良時間,可以將原來需要10年的品種改良時間縮短到約1年半。
未來的一個重要目標必須是提高核酸酶的安全性和特異性,提高檢測脫靶事件的能力,掌握預防方法。ZFNs中使用的鋅指很少完全特異,有些還可能引起毒性反應。對ZFN的切割結構域進行修飾可以降低毒性。
此外,要加強對DNA重組和DNA修復機制的認識。
CRISPR的簡易性和低成本,使得其獲得廣泛的研究和應用。由於其精確性和效率,CRISPR和TALEN都有望成為大規模生產中的選擇。
基因編輯
CRISPR/Cas9是繼“鋅指核酸內切酶(ZFN)”、“類轉錄激活因子效應物核酸酶(TALEN)”之後出現的第三代“基因組定點編輯技術”。與前兩代技術相比,其成本低、製作簡便、快捷高效的優點,讓它迅速風靡於世界各地的實驗室,成為科研、醫療等領域的有效工具。CRISPR/Cas9技術被認為能夠在活細胞中最有效、最便捷地“編輯”任何基因。
2、特異突變引入:如果想把某個特異的突變引入到基因組上,需要通過同源重組來實現,這時候要提供一個含有特異突變同源模版。正常情況下同源重組效率非常低,而在這個位點產生DSB會極大的提高重組效率,從而實現特異突變的引入。
3、定點轉基因:與特異突變引入的原理一樣,在同源模版中間加入一個轉基因,這個轉基因在DSB修復過程中會被拷貝到基因組中,從而實現定點轉基因。通過定點轉基因的方法可以把基因插入到人的基因組AAVS1位點,這個位點是一個開放位點,支持轉基因長期穩定的表達,破壞這個位點對細胞沒有不良影響,因此被廣泛利用。
有著“豪華版”諾獎之稱的“2015年度生命科學突破獎”頒發給了發現基因組編輯工具“CRISPR/Cas9”的兩位美女科學家——珍妮弗·杜德娜和艾曼紐·夏邦傑。二人更是獲得了2015年度化學領域的引文桂冠獎——素有諾獎“風向標”之稱,曾被認為是2015年諾貝爾化學獎的最有力競爭者。
2018年11月,中國深圳的科學家賀建奎宣布,他們團隊創造的一對名為露露和娜娜的基因編輯嬰兒在中國誕生。這對雙胞胎的一個基因經過修改,使她們出生后就能天然抵抗艾滋病,這是世界首例免疫艾滋病的基因編輯嬰兒。
2018年12月,美國一家基因編輯公司宣布,將啟動一項利用CRISPR基因編輯技術治療某種遺傳性眼疾的臨床試驗,相關申請已被美國監管部門接受。在這一臨床試驗中,基因編輯的對象是先天性黑朦病患者眼睛里的感光細胞,這是一種體細胞,而非生殖細胞。體細胞的遺傳信息不會遺傳給下一代,所以不涉及倫理道德問題。
2020年2月8日,在美國進行的一項臨床試驗顯示,經過體外多次基因編輯的免疫細胞可在癌症患者體內存活數月,表明這種方法未來有望用於抗癌和治療其他疾病。
2020年12月11日,日本厚生勞動省通過其國內首個基因編輯食品的銷售申請。這是一種基因編輯的西紅柿,含有更多營養成分γ-氨基丁酸,預計最早將於2022年上市銷售。

基因編輯
基因編輯是人對身體的遺傳密碼做出的修改,對此,人類早就有多種倫理原則進行規範,其中的一個原則是,必須要有國家級的政府倫理機構批准,並且尚不能允許經過基因修改的嬰兒出生,即便要用人的胚胎進行研究,也一般限於14天的胚胎,即胚胎髮育到14天後必須銷毀,不能發育成長為人。因此,所謂“免疫艾滋病基因嬰兒”的出生,有違目前公認的倫理和倫理管理原則,不啻於以科學之力創造了“弗蘭肯斯坦”。
而且事件顯得撲朔迷離。網上流傳的“醫學倫理審查申請書”顯示,批准這次基因編輯實驗的是深圳和美婦兒科醫院,這是一家民營資本醫院,而且之前有不少的負面新聞。但是,該院否認嬰兒出生在他們那裡;該醫院倫理委員會前成員甚至稱“簽名是偽造的”。這麼一起人命關天的人體試驗,到底有沒有經過合法的醫學倫理審查?是不是存在造假問題?
其次,賀建奎強調,對嬰兒的基因編輯是出於治療目的。但是,阻斷艾滋病母嬰傳播的技術已經很成熟,什麼樣的“治療目的”,需要對嬰兒進行基因編輯?
第三,賀建奎本人在2017年年初還撰文稱:“CRISPR-Cas9是一種新技術,我們需要更多深入的研究和了解。不論是從科學還是社會倫理的角度考慮,沒有解決這些重要的安全問題之前,任何執行生殖細胞系編輯或製造基因編輯的人類的行為是極其不負責任的。”那麼,為什麼短短一年之後基因編輯嬰兒就在賀建奎手中降生了?這是不是“極不負責任的”?科學家的態度發生了180度的大轉彎,背後有沒有不正當的利益糾葛?
此外,由於基因剪刀CRISPR/Cas9具有不穩定性,經常脫靶,因此對人的傷害不小;而且,敲除這個靶點後有沒有其他潛在威脅,會不會產生蝴蝶效應?同時,包括《科技日報》在內的科學界媒體也在質疑:基因編輯是否能完全有效地防止感染艾滋病病毒?如何來證明?
“人是目的本身,而不是手段”,應該是基因領域的金科玉律。那兩個叫露露、娜娜的孩子,是活生生的人,擁有自己獨立的人格和價值,不是實驗的材料。基因被編輯過的嬰兒降臨人間,對於人類歷史是一個大事,我們做好了足夠準備了嗎?打開潘多拉的魔盒,當慎之又慎,哪怕盒子里裝的是希望。
2020年12月26日第十三屆全國人民代表大會常務委員會第二十四次會議通過《中華人民共和國刑法修正案(十一)》,在刑法第三百三十六條后增加一條,作為第三百三十六條之一:“將基因編輯、克隆的人類胚胎植入人體或者動物體內,或者將基因編輯、克隆的動物胚胎植入人體內,情節嚴重的,處三年以下有期徒刑或者拘役,並處罰金;情節特別嚴重的,處三年以上七年以下有期徒刑,並處罰金。”
