唐納爾·托馬斯
唐納爾·托馬斯
愛德華·唐納爾·托馬斯(Edward Donnall Thomas)(1920年3月15日-2012年10月20日),美國醫生。曾任西雅圖華盛頓大學大學教授、西雅圖弗雷德·哈金森癌症研究中心(Fred Hutchinson Cancer Research Center)臨床研究部主任。1990年,與約瑟夫·默里一起由於在“人體器官和細胞移植的研究”的貢獻而獲得諾貝爾生理學或醫學獎。E. Donnall Thomas 2012年10月20日於西雅圖去世,年92歲。
唐納爾·托馬斯1920年出生於美國德克薩斯州馬特鎮。1937年就讀於馬特高中。1941年,他在奧斯丁的德克薩斯大學獲得了文學學士,1943年取得碩士學位。之後,他轉學入哈佛醫學院並於1946年獲得了醫學碩士學位。獲得碩士學位后,他進入了波士頓的彼得·本特·布利格漢姆醫院(Peter Bent Brigham Hospital)實習,在那裡學習血液學。1948年到1950年間,他應徵入伍,在陸軍中擔任內科醫生。退役后,他進入馬薩諸塞科技學院以博士後學術研究員身份鑽研白血病的治療方法。1951年,他成為麻省理工學院學者,1955-1963年間為哥倫比亞大學醫學講師,1963年做為華盛頓大學醫學教授。1955年到1963年,他被紐約州庫伯斯敦的瑪麗·伊莫格尼·巴塞特醫院(Mary Imogene Bassett Hospital)聘為主治醫師。

托馬斯在實驗室

1990獲獎后在西雅圖的合影(中)
1990年,托馬斯榮獲美國國家科學獎章。
《including Aplastic Anemia 》(再生障礙性貧血)(1978)
《Frontiers on Bone Marrow Transplantation: Fetal Hematopoiesis 》(骨髓移植前沿:胎兒造血)(1991)
《Hematopoietic Cell Transplantation 》(造血幹細胞移植)(1999年與人合著)
四百多年前,列子湯問篇曾經記載,我國古代名醫扁鵲為兩位心臟陰陽失調的病患,互換心臟,古代的外科技術,免疫學觀念及藥物的療效不能和現代醫療相比,但是移植的觀念已經開始萌芽了,事實上,四千多年前的埃及人就希望能將聰明的人類移植到強壯的獅子身上,創造人面獅身的造型。
在1990年諾貝爾生理醫學獎就頒給了美國西雅圖華盛頓大學佛雷德-哈金森(Fred-Hutchison)醫學中心的托馬斯(E. donnall Thomas)醫師,及波士頓哈佛大學布利格漢姆醫院的默里(J. Murray)外科醫生。托馬斯醫生的貢獻在於骨髓移植,而默里則為腎臟移植的開創者。
這是長久以來,諾貝爾醫學獎頒給臨床醫師而非基礎醫學研究者。一般而言,臨床醫學較傾向於應用科學,其創造性及影響層面比不上基礎科學的成就。然而,移植(transplantation)醫學的發展,除了為了人類疾病的治療開啟了一條嶄新的途徑外,也開啟了免疫學很重要的一頁。而默里及托馬斯則分別代表移植醫學兩個大分枝的開創、奠基及實際工作者,因此獲獎也就實至名歸了。
移植手術乃將甲[捐贈者(donor)]的器官或組織移給乙[病人或受體(recipient)]。在1950年代之前,免疫學尚未十分發達,所有嘗試把甲的器官捐贈給乙病人的移植手術(或稱異體移植)皆無法成功,而原因為何也不明了。移植手術最初是由腎臟移植開始,因腎有兩個且解剖學構造較單純。1936年俄國的一個外科醫師佛洛諾伊(Voronov)第一次進行了腎臟的異體移植手術,但並未成功。其後另有一些醫師嘗試同樣的手術,病人也均在短期內死亡而失敗。
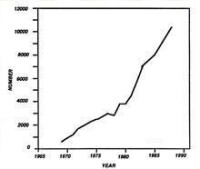
(圖一)歐洲從1965到1990腎臟移植的數目
為了解決異體移植間的排斥現象,1959年默里及法國巴黎的漢伯格(Hamburger),利用全身大量輻射以抑制受體的免疫攻擊,他們同時在兩地進行了兩例成的非雙生子間的異體腎移植,更進一步確認了免疫排斥的重要概念。
默里的這兩項開創性工作,可能是他超越眾多同儕競爭而獲得諾貝爾獎的原因。後來在腎臟移植的進展上,雖另有眾多研究者的一些貢獻(腎臟移植病患的存活時間正逐年提升) (圖二),但皆在觀念上延續默里的工作,而只做藥物及技術上的改進而已。
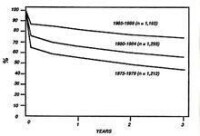
(圖二)由屍體器官移植后1-3年的存活率
人體中負責執行這一排斥任務的是T細胞淋巴球,當T細胞淋巴球發現外來的人類淋巴球抗原蛋白,馬上就會受到激化,進而破壞移植體(graft)。所以當初默里從事同卵雙生子的腎移植,以及後來以放射線破壞免疫系統而成功地進行異體腎移植,以目前免疫學的發展來說,都是一種開創性的工作,也奠定了日後移植免疫學的發展。
默里於1961年又與英國劍橋大學的卡爾尼(Calne)合作,以一種免疫抑製藥物:azathioprine,成功地使用於腎臟移植患者的身上,克服了排斥的重大障礙,使腎臟移植於1960至1980年間,成了全世界各醫學中心用來治療腎衰竭或尿毒病人的重要醫療措施。1980年起,英國的卡爾尼小組又發現了一種到目前為止最理想的免疫抑製劑:環孢靈素(cyclosporin),配合血液透析技術的應用,腎臟移植成了全世界尿毒患者的新生希望。目前在捐贈器官的主要組織符合抗原配合要求,已因理想免疫抑製劑(immunosuppressive regimen)的使用而比過去寬鬆,這些完全拜賜於移植免疫學的發展,以及新的理想免疫抑製劑的發現,默里等人在這方面的理論及實際上的貢獻,居功厥偉。
腎臟移植的進展也帶動了人體其他器官移植的進展,如肝、胰、心臟、肺臟等,其成功率也日益改善。
默里的父母、家庭醫師都是有知識的人,並且他們都運用所掌握的知識為社會服務、為他人服務,並贏得了他人的尊敬。也因此使得童年的他懂得了:要做一個有知識的人,並且回報社會。所以他堅定信念,長大后要當一名醫生,為千千萬萬受病痛折磨的人服務。他認為要做好醫生,要先做好人;因此他選擇了先上文科大學,再進入哈佛大學醫學院。也因為出於對病人的強烈同情心和對事業的高度責任心,使他敏銳的捕捉到了其他人以視若無睹的課題-----皮膚異體移植的排斥現象。如今,他對移植方面的成就使成千上萬的人透過器官移植挽救了生命、獲得了新生。
骨髓移植的托馬斯醫師,則代表著移植醫學另一大分枝的大師型人物。托馬斯於1920年出生德州,和默里一樣,也畢業於哈佛大學醫學院,且亦工作於布利格漢姆醫院。托馬斯後來由東部搬移到西部的華盛頓大學,華大的托馬斯骨髓移植中心自一九七○年代起,因傑出的骨髓移植,成為血液及腫瘤醫師的麥加聖城。進入一九九○年代,該中心每年的進行三百五十例骨髓移植,成功率達百分之七十到八十,救活了無數白血病病人。
骨髓移植與腎臟及其他器官移植有一項截然不同的問題存在,使得骨髓移植變得更為複雜與困難。在骨髓移植中,因輸入的骨髓細胞內即存在著捐贈者的免疫細胞,因此一旦移植成功,除了一般器官移植所發生的宿主對植體的可能排斥外,植入的免疫細胞亦會發揮辨識功能,反而攻擊宿主的組織,而導致一種嚴重的「植體對宿主反應」 (graft versus host disease,GVHD)。植體對宿主的反應有可能嚴重破壞皮膚及腸胃等器官。
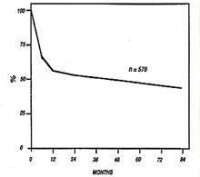
(圖三)骨髓移植治療嚴重的骨髓白血病
自1969年起,托馬斯即採取一連串措施,以克服植體到宿主反應的發生及防治,使得骨髓移植的成功率大增。除了在人類淋巴球抗原配合捐贈者的選擇外,托馬斯更首次以methotrexate來抑制免疫攻擊所引起的植體到宿主反應,以後類固醇的使用以及近年來環孢靈素的應用,使植體對宿主反應的控制更加理想,而骨髓移植的成功率也大為改善。
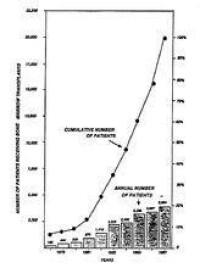
(圖四)同種異體間骨髓移植的數目
很清楚地,骨髓移植除了要應付宿主免疫系統到輸入骨髓細胞的攻擊外,還要克服植體到宿主反應,而後者的嚴重性更甚於前者,其中的關鍵仍是人類淋巴球抗原系統的配合與否,在這方面骨髓移植的要求比腎移植更嚴格,捐贈者的選擇往往只限於人類淋巴球抗原配合的兄弟姊妹。然而,因為異基因骨髓移植必須是在捐髓、及受髓者雙方,「人類白血球抗原」即HLA相符下才得以進行。每個人的HLA型分別從父母雙方各獲一半的遺傳,因此兄弟姊妹間各有四分之一相同的機率;但往往患者在兄弟姊妹中找到「HLA」相符者的機會不多,以致許多病患喪失了此唯一機會,只能陷入死亡的絕望中。
幸運的,在1982年左右,一次偶然的機緣,醫界又證實,在非血親間也可能找到「HLA」相符的捐髓者進行捐贈移植,只是無血緣關係的人,能有相同HLA型機率那就更小了。
因此醫界提出,如果收集足夠愛心人士的HLA資料,供病人尋找配對,將能挽救更多珍貴的生命。
所以,在1986至1987年間,美國、歐洲等先進國家都先後成立了「骨髓捐贈資料中心」,將所有有心捐贈骨髓者的「HLA」資料集中起來,存入計算機,一旦有任何需做骨髓移植的病患,就能透過此資料中心尋找HLA型相符合的有緣人,以進行移植。
