腐蝕理論
腐蝕理論
腐蝕是指因工程材料與其周圍的物質發生化學反應而導致解體的現象。通常這個術語用來表示金屬物質與氧化物如氧氣等物質發生電化學的氧化反應。例如,使用金屬鐵製成的產品會由於鐵原子在固體溶劑中發生氧化而導致生鏽,這就是電化學腐蝕的一個眾所周知的例子。這種反應通常會產生對應金屬的氧化物,也可能產生鹽。換句話說,腐蝕指的是金屬物質因化學反應而導致的損耗。
目錄
腐蝕是指(包括金屬和非金屬)在周圍介質(水、空氣、酸、鹼、鹽、溶劑等)作用下產生損耗與破壞的過程。
金屬材料以及由它們製成的結構物,在自然環境中或者在工作條件下,由於與其所處環境介質發生化學或者電化學作用而引起的變質和破壞,這種現象稱為腐蝕。其中也包括上述因素與力學因素或者生物因素的共同作用。某些物理作用,例如金屬材料在某些液態金屬中的物理溶解現象也可以歸入金屬腐蝕範疇。一般而言,生鏽是專指鋼鐵和鐵基合金而言的,它們在氧和水的作用下形成了主要由含水氧化鐵組成的腐蝕產物——鐵鏽。有色金屬及其合金可以發生腐蝕但並不生鏽,而是形成與鐵鏽相似的腐蝕產物。如銅和銅合金表面的銅綠,偶爾也被人稱作銅銹。
腐蝕破壞的形式種類很多。在不同環境條件下引起金屬腐蝕的原因不盡相同,而且影響因素也非常複雜。為了防止和減緩腐蝕破壞及其損傷,通過改變某些作用條件和影響因素而阻斷和控制腐蝕過程,由此所發展的方法、技術及相應的工程措施已成為防腐蝕工程技術。
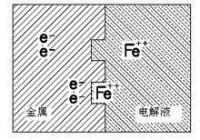
鐵腐蝕后形成Fe++
鐵離子被氧化進入水中后,金屬中帶上了負電荷,電解液中帶上了正電荷,於是金屬和水之間產生了一個電壓,稱為氧化電壓或氧化電動勢。這就好比在很小的局部形成了一個微小的化學電池。不同的金屬在水中形成的氧化電動勢是不一樣的。有些金屬,例如鎂和鋅,形成的電動勢比鐵要高。有些金屬,例如銅、鎳、鉛形成的電動勢比鐵要小。表 列出了25℃下一些水中的電極反應電動勢。這些電動勢還會隨著溫度、pH值、離子濃度的變化而變化。氧化電動勢對於理解大部分腐蝕過程十分重要。
| 元素 | 電極反應 | 電動勢/V |
| 鈉 | Na→Na+e | -2.712 |
| 鎂 | Mg→Mg+2e | -2.34 |
| 鈹 | Be→Be+2e | -1.70 |
| 鋁 | Al→Al+3e | -1.67 |
| 錳 | Mn→Mn+2e | -1.05 |
| 鋅 | Zn→Zn+2e | -0.762 |
| 鉻 | Cr→Cr+3e | -0.71 |
| 鐵 | Fe→Fe+3e | -0.44 |
| 鎘 | Cd→Cd+2e | -0.402 |
| 鈷 | Co→Co+2e | -0.277 |
| 鎳 | Ni→Ni+2e | -2.250 |
| 錫 | Sn→Sn+2e | -0.136 |
| 鉛 | Pb→Pb+2e | -0.126 |
| 銅 | Cu→Cu+2e | +0.345 |
| 銅 | Cu→Cu+e | +0.522 |
| 銀 | Ag→Ag+e | +0.800 |
| 鉑 | Pt→Pt+2e | +1.2 |
| 金 | Au→Au+3e | +1.42 |
這樣,金屬的表面就會有大量的微電池,如圖7-15所示。當這些微電池被外部的電解液或導電體連通時,腐蝕就會發生。正是微電池提供的這點微小的電流使得腐蝕的化學反應得以進行。例如,考慮圖7-14所示的鐵片泡在水裡面的情形,若假設鐵片表面的微電池是均勻的,溶液也是均勻的,則隨著鐵離子進入溶液,溶液會帶正電荷,鐵片會帶負電荷,從而形成一個從溶液指向鐵片的電動勢。該電動勢會阻止鐵離子繼續進入溶液。但是實際情況是,鐵片表面是不均勻的,溶液內也有雜質,因此情況會變得更加複雜。鐵片和溶液之間並無法形成可以阻止鐵離子進入溶液的逆電動勢。在這種情況下,某些局部點會被腐蝕得比較厲害,形成腐蝕坑。
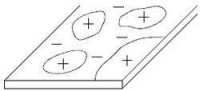
圖7-15 金屬表面的微電池
因此只有通過去電子步把氧化步產生的自由電子去掉,金屬原子才會被不斷地腐蝕下來。實際的腐蝕過程是一個十分緩慢的、表面相對均勻的丟失金屬原子的過程。在某些條件下,若有一個區域形成一個陽極或者陰極區,則可能發生不均勻腐蝕,在局部形成一個肉眼可見的腐蝕坑。
鐵和鋼在水中由於表面會形成氧化保護層,因此不會迅速被腐蝕掉。由於鐵被氧化后極容易形成三氧化二鐵,它不溶於水,容易在金屬表面沉積,從而阻礙進一步的腐蝕。這種現象稱為腐蝕鈍化現象。鋯、鉻、鋁、不鏽鋼等金屬在常溫的水或空氣中會形成很薄的一層保護層,有時候甚至薄得肉眼無法辨別。正是由於這層薄薄的保護層,使得這些金屬在水或空氣中具有很好的耐腐蝕性。
除了鈍化現象以外,還有一種阻止腐蝕的方式稱為極化現象。隨著“氧化-去電子”反應的進行,腐蝕原電池的電動勢逐漸下降直到為零,使得“氧化-去電子”反應無法繼續,這種現象稱為極化。