氧循環
氧循環
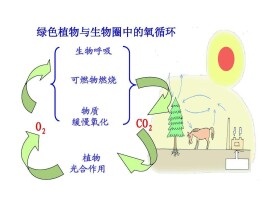
氧元素在自然界的循環狀態。動植物的呼吸作用及人類活動中的燃燒都需要消耗氧氣,產生二氧化碳。但植物的光合作用卻大量吸收二氧化碳,釋放氧氣,如此構成了生物圈的氧循環(氧循環和碳循環是相互聯繫的).。氧在各圈層中的濃度如下(括弧內數字為元素的丰度次序):地球整體:28.5%(2)地殼:46.6%(1)海洋:總量85.8%(1)溶解氧量,15℃時為6mg/kg(13)大氣:23.2%(2)。
所有元素中,唯有氧是同時在地殼、大氣、水圈和生物圈中都有著極大丰度的元素。因此,在生物界和非生物界,元素氧都有著極端重要的地位。
按照化合物形態,氧的各種化合物在地球表面的丰度排列次序如表2-3所示,列於首位的無機氧主要是指岩石硅酸鹽中所含氧。表中還列舉了氧在各儲層中含有量的估計值。
在地殼中,形成岩石的礦物質中約95%是硅酸鹽,其主要結構單元是四面體的[SiO44-]。其餘5%的組分也大多含有氧元素,如石灰岩中碳酸鹽(CO32-)、蒸發岩中硫酸鹽(SO42-)、磷酸鹽岩石中的磷酸鹽(PO43-)等。氧的離子半徑是140pm(1pm=10-12m),除鈣(100pm)、鈉(102pm)、鉀(138pm)外,地殼岩石中其他主要元素的離子半徑都小於80pm。正因為氧具有特別大的離子半徑,所以以體積計的地殼元素組成中,氧佔了極大的比例。當SiO44-這類含氧基團在岩石發生風化碎裂時,通常仍能以不變的原形進入地球化學循環,即隨水流遷移到海洋,進入海底沉積物,甚至重新返回陸地,因此,地殼中存在的氧可看成是化學惰性。
大氣中的氧主要以雙原子分子O2形態存在,並且表現出很強的化學活性。這種化學活性足以影響能與氧生成各種化合物的其他元素(如碳、氫、氮、硫、鐵等)的地球化學循環。大氣中的氧氣多數來源於光合作用,還有少量系產生於高層大氣中水分子與太陽紫外線之間的光致離解作用。
在此反應中同時產生H2逸散到大氣空間。
在紫外光作用下,大氣中氧能轉變為三原子分子臭氧。第一步是氧分子通過光解反應生成氧原子:
隨後,氧原子和氧分子結合生成臭氧分子
O+O2→O3
通過以上反應,在距地面約10~40km的大氣層上空形成了臭氧層,正常情況下,臭氧分子的形成過程和隨後的分解過程在臭氧層中達到平衡(詳見7.8.1),所以,臭氧層中的臭氧具有大體恆定的濃度;又由於臭氧的生成和分解都需要吸收紫外光,所以臭氧層成為地球上各種生物抵禦來自太陽過強紫外光輻射的天然屏障。臭氧層對於地球生物,有著生死攸關的作用。
在組成水圈的大量水中,氧是主要組成元素;在水體中還有各種形式的大量含氧陰離子以及相當數量的溶解氧,它們無不對水圈或整個生物圈中的生物有著極為重要的意義。
各種含氧化合物在氧循環中發生遷移和轉化的情況如圖2-12所示。在圖中所示的各種過程中,許多別的元素也隨同氧元素一起進行著循環。
在生物光合作用和呼吸作用的過程中,參與氧循環的物質有CO2、H2O等。化石燃料的燃燒和有機物腐爛分解過程則是與呼吸作用具有類似情況的一類氧化反應。
由於火山爆發或有機體腐爛產生H2S,能在大氣中進一步被氧化為含氧化合物SO2,化石燃料燃燒及從含硫礦石中提取金屬的過程中也都能產生SO2,這些SO2在大氣中被氧化為SO42-,然後通過酸雨形式返轉地面。相似地,由微生物或人類活動產生的各種氮氧化合物最終也被氧化為NO3-,然後通過酸雨形式返回地面。
在陸地(也少量地發生在海洋中),有許多金屬通過氧化過程轉化為不溶性氧化物;也有一些還原性的非金屬可能被氧化為溶解性更大的化合物。如:
4Fe2++3O2 → 2Fe2O3
(易溶) (難溶)
S2-+2O2 → SO42-
(難溶) (易溶)
大氣中的氧和水體中的溶解氧之間存在著溶解平衡關係。當由於某種外來原因引起平衡破壞時,該水-氣體系還具有一定的自動調節、恢復平衡的功能。例如當水體受有機物污染后,水體中的細菌當即降解有機物並耗用水中溶解氧,被消耗的溶解氧就由大氣中的氧通過氣-水界面予以補給。反之,當大氣中氧的平衡濃度由於某種原因(例如岩石風化加劇)低於正常濃度時,則水體中溶解氧濃度也相應低落。由此,水體中有機物耗氧降解作用緩慢下來,相反地促進了水生生物的光合作用(增氧過程),這樣就會進一步引起表面水中溶解氧濃度逐漸提高到呈過飽和狀態而逸散到大氣中去。