硫酸鹽
硫酸根離子與其他金屬離子組成的化合物
硫酸鹽,是由硫酸根離子(SO4 )與其他金屬離子組成的化合物,都是電解質,且大多數溶於水。硫酸鹽礦物是金屬元素陽離子(包括銨根)和硫酸根相化合而成的鹽類。由於硫是一種變價元素,在自然界它可以呈不同的價態形成不同的礦物。當它以最高的價態S與四個O結合成SO4,再與金屬元素陽離子即形成硫酸鹽。在硫酸鹽礦物中,與硫酸根化合的金屬陽離子有二十餘種。就是說有含硫酸根的鹽就是硫酸鹽。
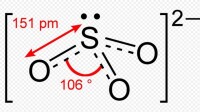
硫酸根
自然界中的硫酸鈣以石膏礦的形式存在。含有兩個結晶水的硫酸鈣(CaSO·2HO)叫做石膏(也叫生石膏)。將石膏加熱到150℃,就會失去大部分結晶水而變成熟石膏(2CaSO·HO)。熟石膏與水混合成糊狀後會很快凝固,轉化為堅硬的生石膏。利用石膏的這一性質,人們常利用它製作各種模型和醫療上用的石膏繃帶。在水泥生產中,可用石膏調節水泥的凝固時間。在石膏資源豐富的地方可以用它來制硫酸。
天然的硫酸鋇稱為重晶石,它是製取其他鋇鹽的重要原料。硫酸鋇不容易被X射線透過,在醫療上可用作檢查腸胃的內服藥劑,俗稱“鋇餐”。硫酸鋇還可以用作白色顏料,並可做高檔油漆、油墨、造紙、塑料、橡膠的原料及填充劑。
硫酸亞鐵的結晶水合物俗稱綠礬(FeSO·7HO)。在醫療上硫酸亞鐵可用於生產防治缺鐵性貧血的藥劑,在工業上硫酸亞鐵還是生產鐵系列凈水劑和顏料氧化紅鐵(主要成分為FeO)的原料。
硫酸銅俗稱膽礬,分子式CuSO·5HO。分子量為249.68。含水量36%。是無水硫酸銅吸水后形成的。膽礬是顏料、電池、殺蟲劑、木材防腐等方面的化工原料。五水硫酸銅在常溫常壓下很穩定,不潮解,在乾燥空氣中會逐漸風化,加熱至45℃時失去二分子結晶水,110℃時失去四分子結晶水,稱作一水硫酸銅。200℃時失去全部結晶水而成無水物。無水物也易吸水轉變為五水硫酸銅。無水硫酸銅(白色或灰白色粉末)吸水后反應生成五水硫酸銅(藍色),常利用這一特性來檢驗某些液態有機物中是否含有微量水分。二者注意區分。將無水硫酸銅加熱至650℃高溫,可分解為黑色氧化銅、二氧化硫及氧氣(或三氧化硫)。

明礬

硫酸鈉
白色有光澤結晶、顆粒或粉末。味甜。在空氣中穩定。86.5℃時失去部分結晶水,250℃失去全部結晶水。當加熱時猛烈膨脹並變成海綿狀物質。燒到赤熱時分解為三氧化硫和氧化鋁。當相對濕度約低25%時風化。易溶於水,幾乎不溶於乙醇,溶液呈酸性。久沸後有不溶性鹼式鹽沉澱。相對密度1.62。硫酸鋁是一個被廣泛運用的工業試劑,通常會與明礬(既十二水合硫酸鋁鉀)混淆。硫酸鋁通常被作為絮凝劑,用於提純飲用水及污水處理設備當中,也用於造紙工業。
硫酸鋁(Aluminum sulfate)應用範圍:
1.用於污水處理作為混凝劑,具有很好的脫色能力,還具有去除重金屬離子、去油、除磷、殺菌等功能,尤其對印染廢水的脫色和去COD、電鍍廢水的鐵氧體共沉澱等效果明顯。
3.硫酸鋁易溶於水,硫酸鋁水溶液微酸性。廣泛用作飲用水,工業用水的凈化處理。適合較低鹼度的廢水處理;作為沉澱劑,去除硫離子,磷酸鹽離子等。
造紙工業中作為松香膠、蠟乳液等膠料的沉澱劑,水處理中作絮凝劑,還可作泡沫滅火器的內留劑,製造明礬、鋁白的原料,石油脫色、脫臭劑、某些藥物的原料等。還可製造人造寶石及高級銨明礬。砷含量不大於5mg/kg的產品可用於水處理絮凝劑。
環境中有許多金屬離子,可以與硫酸根結合成穩定的硫酸鹽。大氣中硫酸鹽形成的氣溶膠對材料有腐蝕破壞作用,危害動植物健康,而且可以起催化作用,加重硫酸霧毒性;隨降水到達地面以後,破壞土壤結構,降低土壤肥力,對水系統也有不利影響。
天然水中硫酸鹽濃度差別甚大,從幾mg/L到數千mg/L(海水中)。
硫酸鹽經常存在於飲用水中,其主要來源是地層礦物質的硫酸鹽,多以硫酸鈣、硫酸鎂的形態存在;石膏、其它硫酸鹽沉積物的溶解;海水入侵,亞硫酸鹽和硫代硫酸鹽等在充分曝氣的地面水中氧化,以及生活污水、化肥、含硫地熱水、礦山廢水、製革、紙張製造中使用硫酸鹽或硫酸的工業廢水等都可以使飲用水中硫酸鹽含量增高。
在大量攝入硫酸鹽后出現的最主要生理反映是腹瀉、脫水和胃腸道紊亂。人們常把硫酸鎂含量超過600mg/L的水用作導瀉劑。當水中硫酸鈣和硫酸鎂的質量濃度分別達到1000mg/L和850mg/L時,有50%的被調查對象認為水的味道令人討厭,不能接受。
